
Действующие российские клинические рекомендации в первой линии терапии неоперабельного метастатического колоректального рака предлагают применять схемы FOLFOX, XELOX или FOLFIRI и дополнять их моноклональными антителами (МКА) цетуксимабом, бевацизумабом или панитумумабом.
Оптимальная последовательность использования моноклональных антител все еще остается нерешенным вопросом.
Именно определению оптимальной последовательности назначения препаратов было посвящено международное исследование STRATEGIC-1 (NCT01910610), проведенное по инициативе французской Мультидисциплинарной исследовательской группы в области онкологии (Groupe Coopérateur Multdisciplinaire en Oncologie, GERCOR).
В нем сравнивались два МКА – цетуксимаб и бевацизумаб – в сочетании с различными режимами химиотерапии. Цетуксимаб представляет собой блокатор рецептора эпидермального фактора роста (анти-EGFR), бевацизумаб – ингибитор фактора роста эндотелия сосудов (анти-VEGF).
Участниками исследования стали 263 пациента с неоперабельным метастатическим колоректальным раком, имеющие дикий тип KRAS/NRAS/BRAF. В соответствии с дизайном они были стратифицированы по следующим признакам: риск по шкале GERCOR, уровень лактатдегидрогеназы в сыворотке крови, наличие метастазов исключительно в печени – и далее рандомизированы в два рукава:
- Рукав А (n =131) – пациенты, получавшие в первой линии терапии FOLFIRI + цетуксимаб непрерывно до прогрессирования или развития непереносимой токсичности; во второй линии терапии – FOLFOX +бевацизумаб до прогрессирования или развития непереносимой токсичности. Стандартная терапия третьей линии для данной группы пациентов не была предусмотрена, поскольку не существует протокола для пациентов, чья опухоль проявила устойчивость к обоим типам химиотерапевтических препаратов (иринотекан и оксалиплатин)и МКА (и анти-EGFR, и анти-VEGF).
- Рукав В (n =132) – пациенты, для которых были предусмотрены три линии терапии. В первой назначалась комбинация OPTIMOX + бевацизумаб (6 циклов), далее проводилась поддерживающая терапия LV5FU2 + бевацизумаб. Затем, если прогрессирование происходило через 3 мес. и более, проводили реинтродукцию оксалиплатина (stop-and-go). Если до прогрессирования проходило менее 3 мес., приступали ко второй линии терапии – FOLFIRI + бевацизумаб до прогрессирования или развития непереносимых токсических эффектов. В третьей линии терапии пациенты получали анти-EGFR, в некоторых случаях в сочетании с иринотеканом.
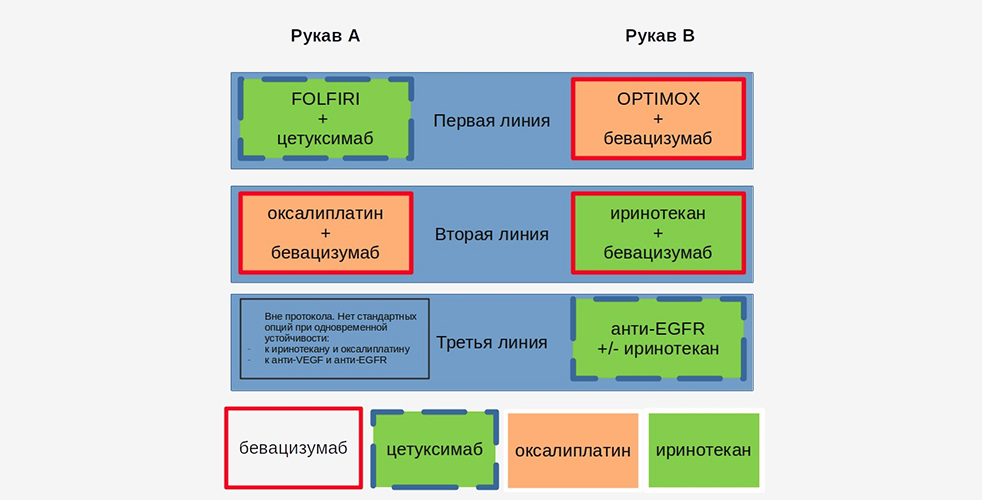
Первичной конечной точкой явилась продолжительность контроля над заболеванием (duration of disease control), которая представляет собой сумму показателей выживаемости без прогрессирования на каждом этапе активного лечения. Вторичными конечными точками стали общая выживаемость, выживаемость без прогрессирования и частота объективного ответа (ЧОО) в каждой линии терапии, частота последующих оперативных вмешательств, безопасность и качество жизни.
Исследование было спланировано так, чтобы продемонстрировать более высокую эффективность терапии рукава В над рукавом А. Однако в результате оказалось:
- при медиане наблюдения 51,2 мес. первичная конечная точка не была достигнута (ОР 0,97; 95% ДИ 0,72–1,29; p = 0,805);
- ОВ была сопоставимой: ОР 1,26 (95% ДИ 0,94–1,70; p = 0,121), для рукавов А и В составила 37,8 и 34,4 мес. соответственно;
- такой важный показатель, как ЧОО, в первой линии продемонстрировал преимущество стратегии рукава А над стратегией рукава В – 82,4 и 65,9% соответственно (p = 0,003). Во второй линии терапии это преимущество сохранялось, хотя и не достигло уровня статистической значимости – 21,2 и 17,2% (p = 0,541). Новых данных по безопасности не было получено.
«Исследование STRATEGIC-1 продолжает целую серию исследований, призванных определить место анти-EGFR антител в первой линии терапии метастатического колоректального рака с диким типом генов KRAS/NRAS/BRAF, – комментирует результаты д.м.н. Алексей Трякин, заместитель директора НИИ клинической онкологии по научной работе, заведующий химиотерапевтическим отделением №2 НМИЦ онкологии им. Н.Н. Блохина. – Так, еще несколько лет назад в двух исследованиях FIRE3 и CALGB 80405 было показано, что у пациентов с отсутствием мутаций в генах KRAS, NRAS и BRAF и левосторонней локализацией первичной опухоли добавление к химиотерапии цетуксимаба позволяет значительно увеличить продолжительность жизни пациентов по сравнению с бевацизумабом. На конференции ASCO в 2022 году было представлено другое крупное исследование PARADIGM, которое также подтвердило полученные результаты. Поэтому, опираясь на имеющиеся на сегодняшний день в распоряжении врача-онколога научные данные, можно сделать вывод о предпочтительном включении в первую линию терапии анти-EGFR антител у пациентов с отсутствием мутаций в генах KRAS, NRAS и BRAF и левосторонней локализацией первичной опухоли, что нашло свое отражение в клинических рекомендациях. Однако довольно часто практикующие врачи выбирают схему терапии, включающую бевацизумаб, в связи с отсроченным получением результатов молекулярно-генетического исследования, а также принимая во внимание более низкую стоимость препарата и отсутствие кожной токсичности, весьма характерной для анти-EGFR препаратов. Более правильной тактикой, с учетом научных данных, является старт химиотерапии без результатов молекулярно-генетического исследования и подключение бевацизумаба или анти-EGFR антител со второго или третьего курса лечения. Ошибочное назначение в первой линии бевацизумаба у этой категории пациентов “крадет” у них около 3,5–6 месяцев жизни».
Цетуксимаб был разработан в 80-х годах XX века в США в рамках инициативы Национальных групп разработки лекарственных препаратов (NCDDG). После проведения ряда клинических исследований в 2004 году препарат был одобрен FDA для лечения колоректального рака. В отличие от анти-VEGF препарата, при колоректальном раке цетуксимаб может в отдельных случаях использоваться в качестве монотерапии, сохраняя при этом свою эффективность.
Препарат одобрен также для терапии плоскоклеточного рака головы и шеи, при котором увеличивает общую выживаемость более чем на 3 мес., согласно данным исследования EXTREME. В России зарегистрирован в 2007 году под торговым наименованием «Эрбитукс».
RU-ERBMCRC-00202
Инструкция по медицинскому применению препарата «Эрбитукс» (цетуксимаб). РУ: ЛСР-002745/09: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=f60bf4bf-c96f-4f37-afd1-df95f8ef046a





















