
Рибоциклиб и эндокринная терапия при ранних стадиях гормоночувствительного HER2-отрицательного РМЖ: исследование NATALEE (NCT03701334)
Группа исследователей под руководством профессора Дэнниса Дж. Сламона (Dennis J. Slamon) из Медицинской школы Дэвида Геффена при Калифорнийском университете (Лос-Анджелес, США) представила результаты предварительного промежуточного анализа исследования 3-й фазы NATALEE (NCT03701334).
Первичной конечной точкой служила выживаемость без признаков инвазивного заболевания (invasive disease-free survival), которая определялась по критериям STEEP.
Поскольку для продолжительного подавления клеточного цикла и запуска гибели опухолевых клеток требуется большая длительность терапии, то для улучшения переносимости одновременно с поддержанием эффективности была выбрана доза РЦ = 400 мг в течение 3 лет.
Мужчины и женщины в пре- и постменопаузе (5101 пациент) были рандомизированы в соотношении 1:1 для лечения РЦ (400 мг/день; 3 недели с последующим перерывом в 1 неделю в течение 3 лет) + ЭТ (летрозол 2,5 мг/сут. или анастразол 1 мг/сут. в течение ≥5 лет) или только ЭТ. Мужчинам и женщинам пременопаузального возраста также назначался госерелин.
По результатам анализа терапия РЦ + ЭТ продемонстрировала существенно большую выживаемость без признаков инвазивного заболевания, чем только ЭТ.
Показатель трехлетней выживаемости без признаков инвазивного заболевания составил 90,4% по сравнению с 87,1%. Анализ вторичных конечных точек (общая выживаемость, безрецидивная выживаемость и выживаемость без отдаленных метастазов) также показал явное преимущество добавления РЦ к лечению. Профиль безопасности РЦ в дозе 400 мг оказался благоприятным.
Исследователи сделали вывод, что данная схема представляет собой предпочтительный метод лечения пациентов с гормоночувствительным HER2-отрицательным РМЖ на стадиях II или III, включая пациентов с N0.
Безопасность и эффективность адъювантной терапии абемациклибом у пациенток с гормоночувствительным HER2-отрицательным РМЖ: исследование monarchE (NCT03155997)
Еще одна группа американских исследователей под руководством онколога Эрики Гамильтон (Erika P. Hamilton) из Исследовательского института им. Сары Кэннон (Теннесси, США) представила результаты изучения другого ингибитора циклинзависимых киназ (CDK4 и CDK6) абемациклиба у пациенток с гормоночувствительным HER2-отрицательным РМЖ высокого риска на ранних стадиях с вовлечением лимфатических узлов.
Почти половина случаев впервые выявленного РМЖ приходится на женщин старше 65 лет. У пациенток более старшего возраста чаще встречаются сопутствующие заболевания и выше риск развития лекарственной токсичности. Цель исследования состояла в том, чтобы оценить эффективность и безопасность препарата в возрастных подгруппах.
Пациентки были рандомизированы (1:1) для ЭТ в течение 10 лет с назначением абемациклиба или без него (на период исследования, равный 2 года).
Медиана наблюдения составила 42 месяца, по истечении которых в обеих возрастных группах (<65 и ≥65 лет) отмечен положительный количественный эффект в виде улучшения выживаемости без признаков инвазивного заболевания на фоне применения абемациклиба + ЭТ по сравнению только с ЭТ. Аналогичные показатели получены и для выживаемости без отдаленных метастазов.
У более пожилых пациенток (≥65 лет) на 5% чаще встречались нежелательные явления ≥3 степени (преимущественно диарея и слабость). Частота нейтропении у них не возрастала, а венозная тромбоэмболия встречалась примерно с одинаковой частотой (≥65 лет – 3,0%; <65 лет – 2,5%).
У более пожилых пациенток (особенно ≥75 лет) чаще встречались серьезные нежелательные явления, что требовало отмены терапии. Это позволяет предположить, что ключевым моментом при ведении таких пациенток может быть более тщательное наблюдение и своевременная коррекция возникающих нежелательных явлений.
Оценка подтипов PAM50 и риска развития рецидивов у женщин с ранними стадиями гормоночувствительного HER2-отрицательного РМЖ в пременопаузе: вторичный анализ результатов исследования SOFT
Команда специалистов под руководством доктора Лорен Браун (Lauren Brown) из Peter MacCallum Cancer Centre (Мельбурн, Австралия) представила результаты вторичного анализа исследования SOFT. Эта работа ранее показала, что у пациенток пременопаузального возраста с РМЖ добавление терапии, направленной на супрессию овариальной функции, к адъювантной ЭТ либо тамоксифеном, либо эксеместаном снижает риск рецидива по сравнению только с терапией тамоксифеном.
Однако применение молекулярно-генетических биомаркеров, которые могли бы облегчить принятие решений об интенсификации ЭТ с помощью супрессии овариальной функции, не изучалось.
Также изучены различия между очень молодыми (<40 лет) и молодыми (>40 лет) женщинами, поскольку РМЖ, диагностированный у женщин очень молодого возраста, часто имеет агрессивную биологию.
Первичной конечной точкой служил интервал времени без системных рецидивов (distant recurrence-free interval). Вторичные конечные точки включали интервал времени без признаков РМЖ (breast cancer-free interval) и безрецидивную выживаемость. Медиана наблюдения составила 12 лет.
Анализ экспрессии генов проводился с помощью исследования NanoString Breast Cancer 360 на РНК, изолированной из образцов тканей, идентифицированных как гормоночувствительный HER2-отрицательный РМЖ.
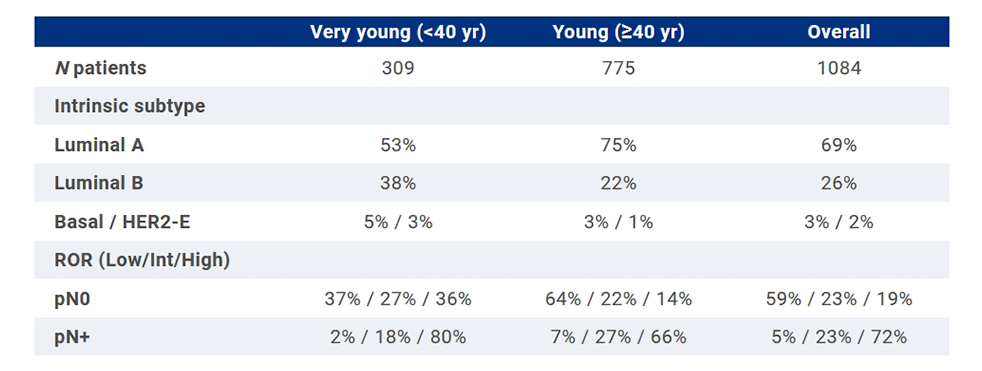
Распределение по подтипам PAM50 существенно варьировалось у женщин очень молодого и пременопаузального возраста: у очень молодых пациенток реже встречался люминальный А подтип и чаще люминальный В подтип и нелюминальные опухоли (p < 0,001). Также сильно различалась оценка риска развития рецидива: у пациенток без поражения лимфатических узлов существенно чаще встречались более высокие показатели риска развития рецидива среди очень молодых женщин по сравнению с молодыми женщинами (36 и 14% соответственно, p < 0,001).
Более подробно распределение по подтипам PAM50 и оценке риска развития рецидива представлено в таблице. Прогностическая ценность данных показателей продолжает изучаться.
Ниволумаб и кабозатиниб в лечении пациентов с несветлоклеточным ПКР
Исследовательская группа под руководством доктора Чан-Хан Ли (Chung-Han Lee) из Memorial Sloan Kettering Cancer Center (Нью-Йорк, США) представила обновленные результаты открытого интервенционного одноцентрового нерандомизированного исследования 2-й фазы NCT03635892.
У пациентов, ранее не получавших терапию ингибиторами иммунных контрольных точек PD-1/PD-L1, выявлен прогрессирующий несветлоклеточный ПКР (измеряемые очаги по критериям RECIST).
Всего 40 пациентов получили Кабо в дозе 40 мг/сут. + Ниво в дозе 240 мг каждые 2 недели или 480 мг каждые 4 недели. Медиана наблюдения составила 34 месяца.
Первичную конечную точку представляла частота объективного ответа (objective response rate) по критериям RECIST; вторичные конечные точки включали выживаемость без прогрессирования, общую выживаемость, длительность ответа и безопасность.
По результатам анализа частота объективного ответа составила 48% (95% ДИ 31,5–63,9); медиана выживаемости без прогрессирования – 13 месяцев (95% ДИ: 7, 16).
Нежелательные явления любой степени тяжести отмечены у 35 пациентов (88%), нежелательные явлений 3–4 степени – у 22 пациентов (55%). Подъем уровня АСТ и АЛТ 3–4 степени выявлен у 18 и 23% пациентов соответственно. Среди других нежелательных явлений 3–4 степени отмечена гипертензия (5, 13%) и боль (4, 10%). У 9 пациентов (28%) исследуемое лечение было прекращено в силу токсичности.
Изучение эффективности и безопасности сочетанной терапии Ниво + Кабо у пациентов с прогрессирующим немелкоклеточным ПКР будет продолжено.
Ленватиниб и пембролизумаб в терапии первой линии несветлоклеточного ПКР: результаты исследования KEYNOTE-B61
Другая группа исследователей представила первоначальные результаты еще одной работы, посвященной изучению лекарственной терапии при прогрессирующем несветлоклеточном ПКР (измеряемые очаги по критериям RECIST).
Ранее не получавшим лечение пациентам назначался ленватиниб в дозе 20 мг перорально 1 р/сут. и пембролизумаб в дозе 400 мг в/в каждые 6 недель (до 18 циклов, т. е. примерно 2 года). Медиана наблюдения составила 14,9 месяца.
Первичную конечную точку представляла частота объективного ответа (objective response rate) по критериям RECIST; вторичные конечные точки включали длительность ответа, частоту контроля заболевания (Disease Control Rate) выживаемость без прогрессирования по критериям RECIST, общую выживаемость и безопасность.
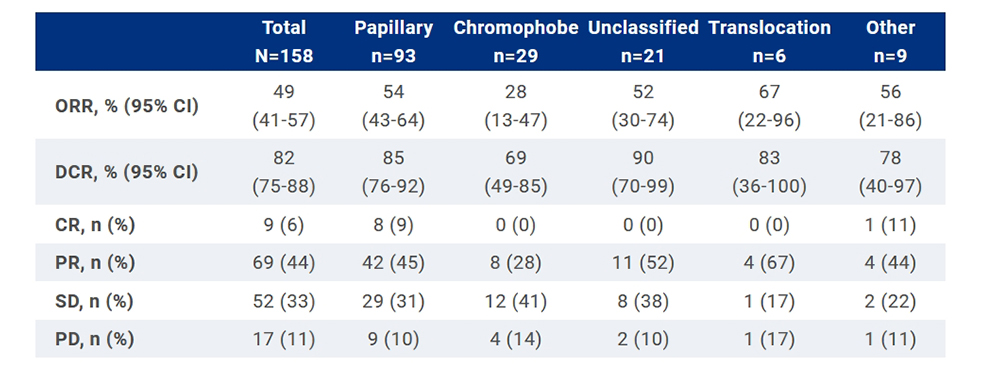
У всех 158 пациентов, получивших лечение, проведена гистологическая оценка опухоли.
Результаты исследования по конечным точкам подробно представлены на рисунке.
Нежелательные явления, связанные с назначенным лечением, возникли у 149 пациентов (94%), что соответствует результатам других исследований.
Исследователи сделали вывод о наличии противоопухолевой активности сочетанной терапии Ленва + Пембро с отсутствием новых сигналов о безопасности. Данные подтверждают возможность использования данной комбинации в качестве терапии первой линии у пациентов с несветлоклеточным ПКР, независимо от гистологии опухоли.
- Рибоциклиб и эндокринная терапия при ранних стадиях гормоночувствительного HER2-отрицательного РМЖ: исследование NATALEE (NCT03701334)
- Безопасность и эффективность адъювантной терапии абемациклибом у пациенток с гормоночувствительным HER2-отрицательным РМЖ: исследование monarchE (NCT03155997)
- Оценка подтипов PAM50 и риска развития рецидивов у женщин с ранними стадиями гормоночувствительного HER2-отрицательного РМЖ в пременопаузе: вторичный анализ результатов исследования SOFT
- Ниволумаб и кабозатиниб в лечении пациентов с несветлоклеточным ПКР
- Ленватиниб и пембролизумаб в терапии первой линии несветлоклеточного ПКР: результаты исследования KEYNOTE-B61

Отношение рисков ОР 0,748; 95% ДИ 0,618–0,906; P = 0,0014.
Оценка эффективности по выживаемости без признаков инвазивного заболевания и выживаемости без отдаленных метастазов (distant relapse-free survival) проводилась в возрастных группах <65 лет (n = 4787; 84,9%) и ≥65 лет (n = 850; 15,1%). Безопасность изучалась среди пациенток ≥65 лет в двух возрастных подгруппах: 65−74 и ≥75 лет.
<65 лет (270 и 414 явлений; ОР = 0,646, 95% ДИ: 0,554, 0,753) и ≥65 лет (66 и 85 явлений; ОР = 0,767, 95% ДИ: 0,556, 1,059).
Распределение по подтипам PAM50 и оценке риска развития рецидива
В подгруппу 1 включены пациенты с папиллярным, неклассифицированным или транслокационными вариантами ПКР; в подгруппу 2 – пациенты с хромофобным ПКР (группа закрыта в связи с отсутствием эффективности).
Выживаемость без прогрессирования составила 51% (95% ДИ: 34, 65) через 12 месяцев и 23% (95% ДИ: 11, 37) через 24 месяца.
Медиана общей выживаемости составила 28 месяцев (95% ДИ: 23, 43).
Общая выживаемость составила 70% (95% ДИ: 53, 82) через 18 месяцев и 44% (95% ДИ: 28, 60) через 36 месяцев.
У 93 (59%), 29 (18%) и 21 (13%) пациента выявлен папиллярный, хромофобный и неклассифицируемый ПКР соответственно. Кроме этого, у 6 пациентов (4%) выявлен транслокационный вариант ПКР, а у 9 (6%) пациентов – другая гистология опухоли.
Результаты исследования по конечным точкам
Чаще всего (≥30%) встречалась гипертензия (n = 90; 57%), диарея (n = 69; 44%) и гипотиреоз (n = 58; 37%). Нежелательные явления 3−4 степени тяжести возникли у 81 пациента (51%). Всего из-за нежелательных явлений 17 пациентов (11%) прекратили лечение Пембро, 14 пациентов (9%) прекратили лечение Ленва, у 5 пациентов (3%) отменены оба препарата. Летальные исходы, связанные с нежелательными явлениями, не отмечены.





















 6/05/2024, 12:29
6/05/2024, 12:29

