
Комбинация ниволумаб + релатлимаб в сравнении с ниволумабом у пациентов с ранее не леченной метастатической или неоперабельной меланомой: двухлетние результаты исследования RELATIVITY-047
Команда профессора Хусейна А. Тоби (Hussein A. Tawbi) из онкологического центра Андерсона при Техасском университете (Хьюстон, США) представила обновленные результаты и вторичный анализ данных через 2 года исследования RELATIVITY-047, где изучалась эффективность и безопасность применения комбинации ниволумаб + релатлимаб у пациентов с ранее не леченной метастатической или неоперабельной меланомой.
В ходе исследования пациенты были рандомизированы в соотношении 1:1 в группу применения комбинации ниволумаба (480 мг) и релатлимаба (160 мг) (n = 355 пациентов) каждые 4 недели и в группу применения только ниволумаба в дозе 480 мг (n = 359 пациентов) каждые 4 недели. Средний период наблюдения составил 25,3 месяца (минимальный – 21,0 месяц). Первичной конечной точкой исследования служила выживаемость без прогрессирования, которая оценивалась по критериям RECIST (версия 1.1); вторичной конечной точкой – общая выживаемость и частота объективных ответов. Также оценивались опухоль-специфическая выживаемость (определяется по летальным исходам от меланомы с исключением летальных исходов от других причин) и эффективность последующей системной терапии.
Исследование показало, что комбинация ниволумаб + релатлимаб значимо превышала результаты по всем вышеуказанным показателям по сравнению с ниволумабом (см. данные таблицы). Комбинация также была эффективнее по данным анализа подгрупп (согласно предыдущим отчетам). Последующая системная терапия назначена 131 пациенту (36,9%) в группе ниволумаб + релатлимаб и 136 пациентам (37,9%) в группе ниволумаба. Токсичность препаратов, которая привела к прекращению лечения, наблюдалась у 61 пациента (17,2%) в группе ниволумаб + релатлимаб и у 31 пациента (8,6%) в группе применения только ниволумаба.
При последующем наблюдении в течение 12,3 месяца комбинация ниволумаб + релатлимаб имела преимущество перед ниволумабом по выживаемости без прогрессирования, общей выживаемости, частоте объективных ответов и опухоль-специфической выживаемости во всей популяции пациентов, а также при анализе подгрупп. Профиль безопасности комбинации оставался в соответствии с предыдущими отчетами без каких-либо новых или неожиданных эффектов. Исследователи планируют представить результаты изучения эффективности последующей системной терапии (по типу терапии, в том числе применению ингибиторов контрольных иммунных точек PD-L1/CTLA-4).
Возможность получения и применения дендритно-клеточных вакцин, нагруженных аутологичными опухолевыми антигенами, при впервые выявленной глиобластоме
Группа специалистов под руководством нейроонколога Даниэлы А. Бота (Daniela A. Bota) из Калифорнийского университета (США) представила окончательные результаты мультицентрового открытого исследования 2-й фазы применения дендритно-клеточных вакцин, нагруженных аутологичными опухолевыми антигенами, при впервые выявленной глиобластоме.
В исследовании приняли участие 55 пациентов (средний возраст – 59 лет) с впервые выявленной глиобластомой (оценка общего статуса онкологического больного по шкале Карновского > 70). Из образца опухолевой ткани, полученной в ходе операции, приготовлен лизат аутологичных опухолевых антигенов. Аутологичные моноциты, полученные с помощью лейкафереза, прошли дифференцировку до дендритных клеток путем культивирования в присутствии интерлейкина-4 и гранулоцитарно-макрофагального колониестимулирующего фактора. Затем дендритные клетки инкубировались с аутологичными опухолевыми антигенами. Вакцина вводилась подкожно в количестве 8 доз после завершения лучевой терапии и химиотерапии темозоломидом.
Первичная конечная точка включала общую выживаемость (> 75%). Вторичные конечные точки включали медиану общей выживаемости и выживаемость без прогрессирования.
По результатам у 97% пациентов сбор моноцитов и культивирование клеток прошли успешно. За 3 года исследования общая выживаемость через 14,6 месяца после включения в испытание составила 52,7% (95% ДИ 39,8, 65,8).
Наиболее частыми нежелательными явлениями, связанными с введением вакцины, были реакции в месте инъекции (16%) и гриппоподобные симптомы (10%), однако у 33% пациентов отмечены судороги.
Исследователи сделали вывод о том, что производство аутологичных дендритно-клеточных вакцин, нагруженных аутологичными опухолевыми антигенами, вполне возможно, а инъекции переносятся хорошо в сочетании с различными режимами терапии на основе темозоломида. Однако запланированных показателей общей выживаемости добиться не удалось: результаты выживаемости без прогрессирования оказались обнадеживающими, но не привели к улучшению общей выживаемости, возможно, в связи с тем, что введение вакцины было ограничено 8 инъекциями. Исследование будет продолжено.
Исследование THOR: преимущества эрдафитиниба над химиотерапией у пациентов с прогрессирующим или метастатическим уротелиальным раком с отдельными аберрациями гена FGFR
Исследователи под руководством доктора Йоханна Лориота (Yohann Loriot) из онкологического отделения Института им. Густава Русси (Вильжюиф, Франция) представили результаты исследования 3-й фазы THOR.
Нарушения в структуре гена FGFR обнаруживаются примерно у 20% пациентов с метастатическим уротелиальным раком. Эрдафитиниб представляет собой пероральный селективный ингибитор тирозинкиназы рецепторов фактора роста фибробластов всех типов (FGFR1, FGFR2, FGFR3 и FGFR4), прошедший ускоренное одобрение FDA для лечения местно-распространенного или метастатического уротелиального рака у взрослых пациентов с аберрациями генов FGFR3 или FGFR2, у которых опухоль прогрессировала после химиотерапии препаратами платины.
В исследовании приняли участие 266 пациентов (средний возраст 67 лет), рандомизированных в соотношении 1:1 для лечения эрдафитинибом (136 пациентов) в суточной дозе 8 мг с увеличением дозы до 9 мг (на основании фармакодинамических показателей) на 14 день или химиотерапии выбранным исследователем препаратом (доцетаксел или винфлунин; 130 пациентов) в/в каждые 3 недели до прогрессирования заболевания или развития непереносимой токсичности.
Первичная конечная точка включала общую выживаемость; вторичные конечные точки – выживаемость без прогрессирования, частоту объективного ответа (objective response rate) опухоли на лечение и безопасность. Медиана последующего наблюдения составила 15,9 месяца.
По результатам исследования показано, что применение эрдафитиниба существенно увеличивает общую выживаемость и снижает риск летального исхода на 36% (медиана общей выживаемости составила 1 год, подробнее см. таблицу). Применение эрдафитиниба также существенно улучшает медианные значения выживаемости без прогрессирования (5,6 и 2,7 месяца) и частоты объективного ответа (46 и 12%) по сравнению с химиотерапией соответственно.
Серьезные нежелательные явления, связанные с лечением, наблюдались у 13% пациентов, получавших эрдафитиниб, и у 24% пациентов, которые проходили химиотерапию. Новые сигналы о безопасности не получены.
Таким образом, в исследовании показаны преимущества эрдафитиниба над химиотерапией у пациентов с прогрессирующим или метастатическим уротелиальным раком с отдельными аберрациями гена FGFR в виде улучшения выживаемости и ответа опухоли на лечение.
Применение ворасидениба в сравнении с плацебо у пациентов с резидуальной или рецидивирующей глиомой II степени с мутацией гена IDH 1/2
Глиомы II степени являются медленно прогрессирующими опухолями мозга с неблагоприятным долгосрочным прогнозом. Существующие методы лечения (хирургическое вмешательство с последующим наблюдением или адъювантной лучевой и химиотерапией) не радикальны и могут сопровождаться краткосрочной и долгосрочной токсичностью. Мутации гена изоцитратдегидрогеназы 1 или 2 (IDH 1 или IDH 2) встречаются примерно в 80 и 4% случаях глиом II степени и являются определяющей характеристикой опухоли, согласно критериям ВОЗ 2021 года.
Исследователи под руководством нейроонколога Инго Меллингхофа (Ingo K. Mellinghoff) из Memorial Sloan Kettering Cancer Center (Нью-Йорк, США) представили результаты первого рандомизированного двойного слепого плацебо-контролируемого исследования фазы 3 INDIGO (NCT04164901), где изучалось таргетное применение ворасидениба у пациентов с глиомой.
Пациенты были рандомизированы в соотношении 1:1 в группу лечения ворасиденибом в дозе 40 мг ежедневно или в группу плацебо ежедневно (циклами по 28 дней). Пациенты были стратифицированы по наличию или отсутствию коделеции 1p19q и исходному размеру опухоли.
Первичной конечной точкой исследования служила выживаемость без радиологического прогрессирования; вторичной конечной точкой – время до следующего вмешательства.
По состоянию на 6 сентября 2022 года в 10 странах был рандомизирован 331 пациент: 168 человек в группу ворасидениба и 163 человека в группу плацебо. Средний возраст составил 40,4 года (от 16 до 71 года).
По результатам в группе ворасидениба выживаемость без прогрессирования оказалась статистически значимо выше, чем в группе плацебо (медиана 27,7 месяца и 11,1 месяца соответственно; отношение рисков (ОР) 0,39; 95% ДИ 0,27–0,56; р = 0,000000067). Время до следующего вмешательства в группе ворасидениба не достигнуто, в группе плацебо составило 17,8 месяца (ОР 0,26; 95% ДИ 0,15–0,43; р = 0,000000019).
Нежелательные явления любой степени тяжести, возникшие у > 20% пациентов, в группе ворасидениба и плацебо включали повышение уровня аланинаминотрансферазы (38,9 и 14,7% соответственно), COVID-19 (32,9 и 28,8% соответственно), утомляемость (32,3 и 31,9% соответственно), повышение уровня аспартатаминотрансферазы (28,7 и 8,0% соответственно), головные боли (26,9 и 27,0% соответственно), диарею (24,6 и 16,6% соответственно) и тошноту (21,6 и 22,7% соответственно).
Эти данные демонстрируют клиническую пользу применения ворасидениба для когорты пациентов с глиомой, где планируется задержка проведения химиотерапии или лучевой терапии.
- Комбинация ниволумаб + релатлимаб в сравнении с ниволумабом у пациентов с ранее не леченной метастатической или неоперабельной меланомой: двухлетние результаты исследования RELATIVITY-047
- Возможность получения и применения дендритно-клеточных вакцин, нагруженных аутологичными опухолевыми антигенами, при впервые выявленной глиобластоме
- Исследование THOR: преимущества эрдафитиниба над химиотерапией у пациентов с прогрессирующим или метастатическим уротелиальным раком с отдельными аберрациями гена FGFR
- Применение ворасидениба в сравнении с плацебо у пациентов с резидуальной или рецидивирующей глиомой II степени с мутацией гена IDH 1/2

Показатели выживаемости по группам
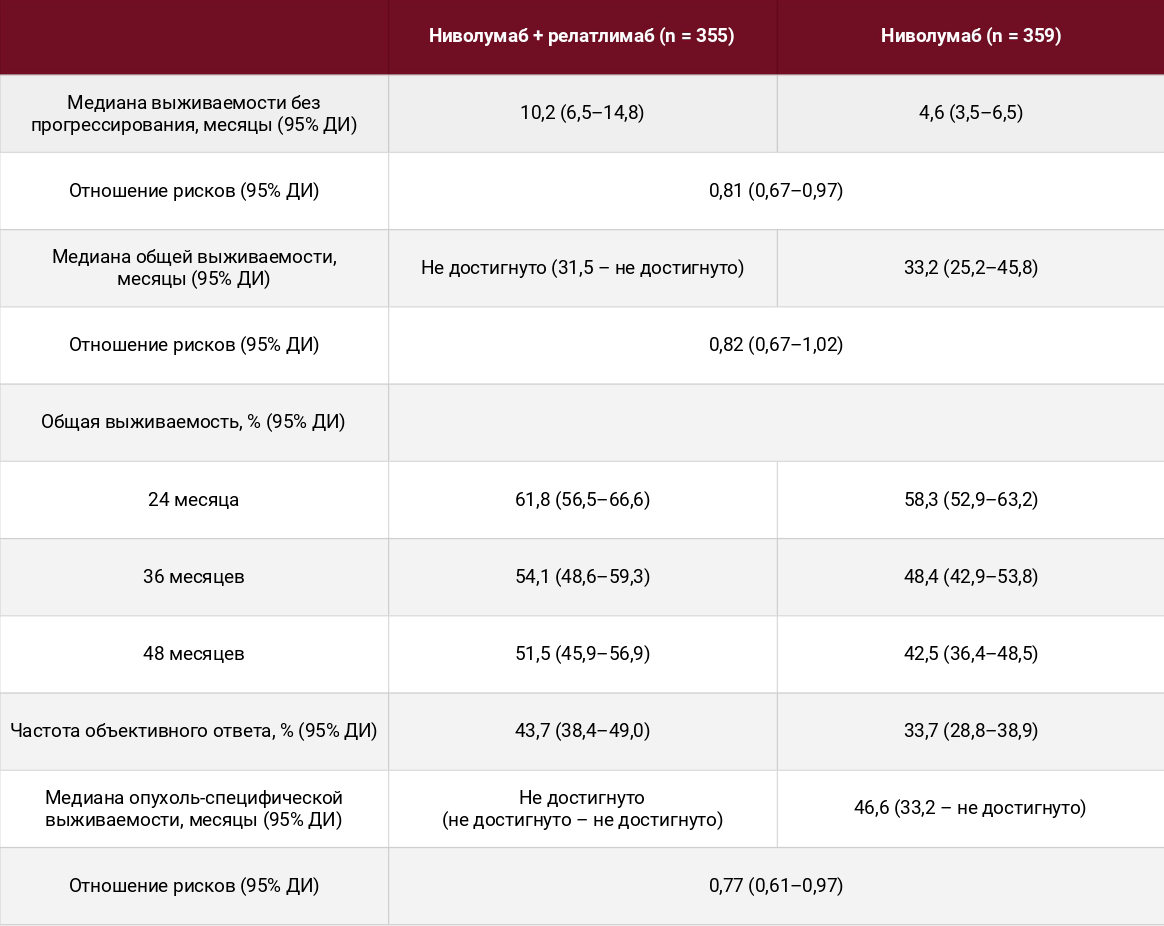
Токсичность 3–4 класса наблюдалась у 78 пациентов (22%) в группе ниволумаб + релатлимаб и у 43 пациентов (12%) в группе ниволумаба. Всего было зарегистрировано 6 смертей, связанных с лечением (4 в группе ниволумаб + релатлимаб, 2 в группе ниволумаба); с момента последнего анализа ни одного нового случая смерти не зарегистрировано.
Медиана общей выживаемости составила 16,0 месяцев (95% ДИ 12,9, 21,7); медиана выживаемости без прогрессирования – 10,4 месяца (95% ДИ 8,6, 11,6). Показатели общей выживаемости через 1, 2 и 3 года составили 70,1, 32,4 и 23,2% соответственно. Более высокие показатели ассоциировались с введением всех 8 доз вакцины (p < 0,0001), с введением дексаметазона в дозе < 2 мг/сутки в начале введения вакцины (p = 0,005), с проведением > 6 циклов терапии темозоломидом (p = 0,0054) и оценкой по шкале Карновского 90 или 100 (p = 0,010) на момент включения в исследование.
Показатели выживаемости по группам
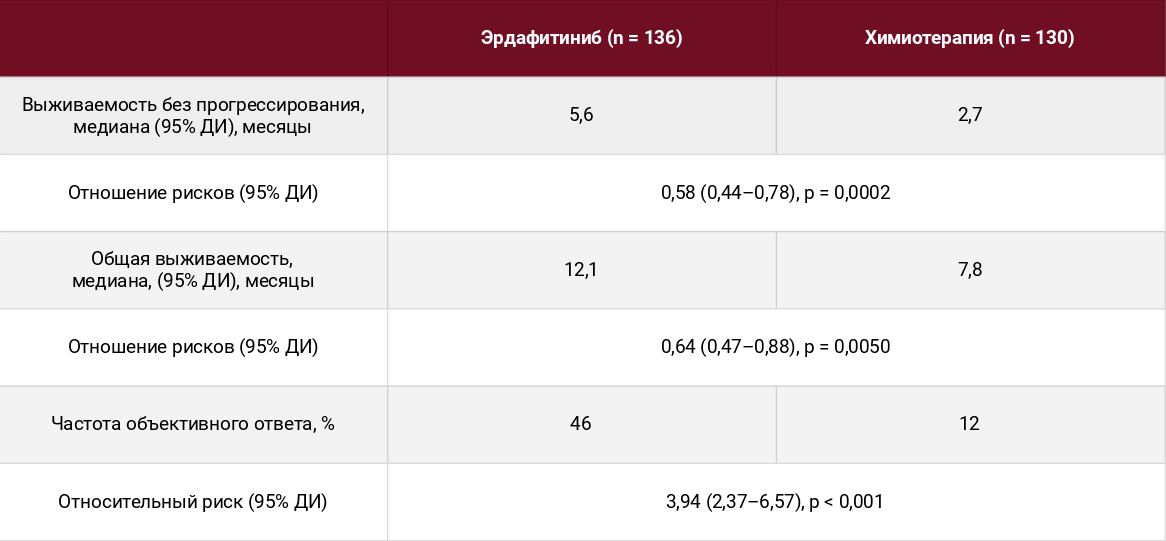
Нежелательные явления 3 и 4 степени тяжести, связанные с лечением, отмечены у 46 и 46% пациентов, получавших эрдафитиниб и химиотерапию, соответственно. Применение эрдафитиниба чаще сопровождалось необходимостью снижать дозу (66%) в связи с развитием нежелательных явлений, связанных с лечением, чем химиотерапия (21%). Сообщается об 1 и 6 летальных случаях в связи с нежелательными явлениями, связанными с лечением, в группе эрдафитиниба и химиотерапии соответственно. У 23 пациентов (17%), получавших эрдафитиниб, выявлена центральная серозная хориоретинопатия (1–2 степени).
Критериями включения служили: возраст пациентов ≥ 12 лет; более 80 баллов по шкале Карновского; остаточная или рецидивирующая олигодендроглиома II степени или астроцитома (с мутациями гена IDH1 или IDH2) без контрастного усиления на МРТ и не нуждающаяся в немедленной химиотерапии или лучевой терапии.
У 53,5% пациентов оценка по шкале Карновского составила 100 баллов; выявлено 172 случая олигодендроглиомы и 159 случаев астроцитомы; среднее время от последней операции до рандомизации – 2,4 года. На лечении оставались 226 пациентов (68,3%; 131 в группе ворасидениба и 95 в группе плацебо).
Нежелательные явления ≥ 3 степени (у > 5% пациентов) включали повышение уровня аланинаминотрансферазы (9,6 и 0% соответственно). Профиль безопасности применения ворасидениба оказался удовлетворительным.





















 6/05/2024, 12:29
6/05/2024, 12:29

