
Введение
По оценкам Американского противоракового общества (The American Cancer Society) [1], к 2030 году в США будет свыше 22,1 млн лиц, перенесших онкологические заболевания. Несмотря на успехи современной медицины, в 2020 году рак оставался второй ведущей причиной смертности в США, уступая только сердечно-сосудистым заболеваниям [2]. Наряду с физическими симптомами, вызванными болезнью, и токсическими эффектами терапии у онкологических больных также отмечают сопутствующие психологические проблемы, причем в большей степени, чем у населения в целом. Распространенность депрессии среди онкологических больных, по оценкам, в 4 раза выше, чем в общей популяции: до 50% пациентов страдают клинической депрессией [3, 4]. Тем не менее официальный диагноз имеют только 25% [5]. Следует отметить, что депрессия связана с ростом показателей смертности и ухудшением прогноза для этой категории больных [3, 6, 7]. Терапия на основе осознанности (ТОО) (Mindfulness-Based Interventions) является перспективным направлением в лечении дистресса и аффективных расстройств у онкологических больных. Несмотря на многочисленные публикации, подтверждающие эффективность ТОО в снижении симптомов депрессии, утомляемости и улучшении качества жизни, исследования, изучающие непосредственную связь ТОО с выживаемостью онкологических пациентов, отсутствуют. Можно предположить, что, поскольку депрессия снижает выживаемость в этой популяции, ее эффективное лечение способно улучшить ситуацию (см. рисунок).
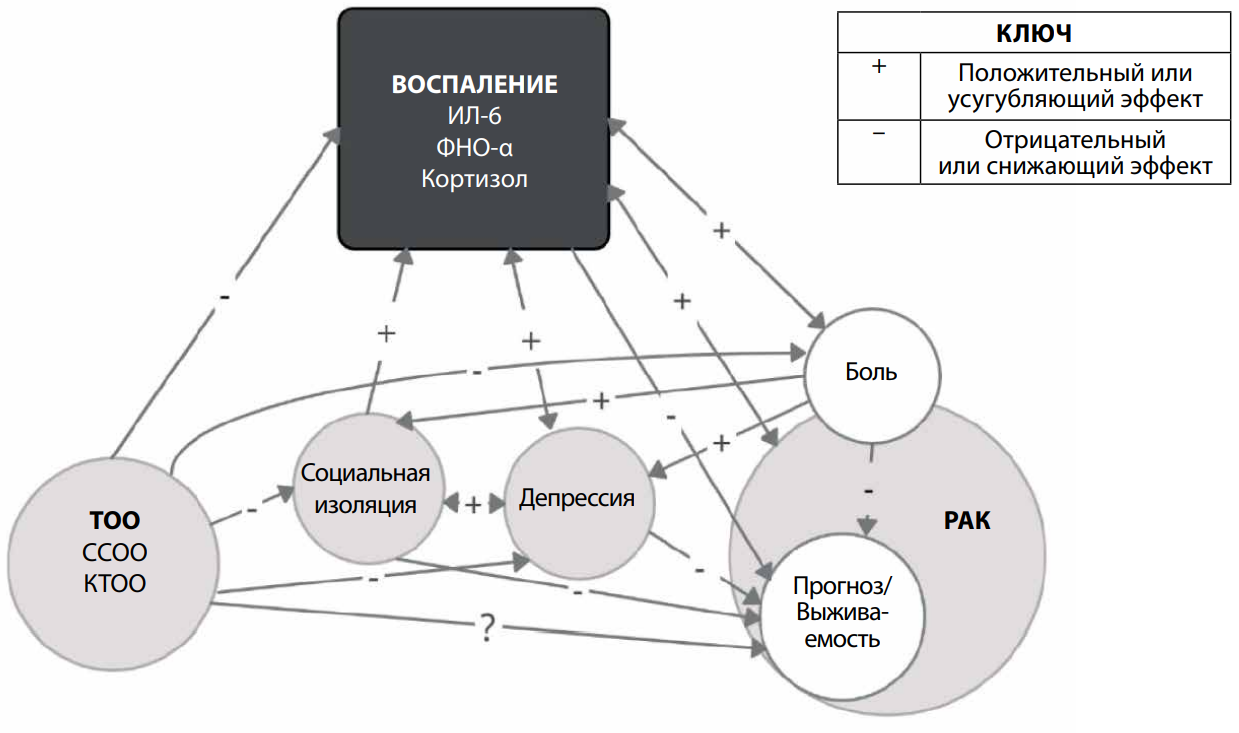
«Осознанность», воспаление и прогноз онкологического заболевания. Данная концептуальная схема иллюстрирует сложные взаимоотношения между этими факторами, указывая на потенциальную положительную связь между терапией на основе осознанности и онкологической выживаемостью Сокращения: ИЛ-6 – интерлейкин-6; ФНО-α – фактор некроза опухолей α; ТОО – терапия на основе осознанности; КТОО – когнитивная терапия на основе осознанности; ССОО – снижение стресса на основе осознанности.
История и обзор концепции и метода осознанности
Происходящее из древней буддистской традиции понятие «mindfulness» означает беспристрастное осознание текущего момента с фокусировкой внимания на теле и дыхании, что позволяет разуму (mind) освободиться от навязчивых мыслей и тревог [8]. Человек, использующий эту методику, воспринимает печальные мысли и негативные эмоции не так остро, что ведет к их большему приятию и общему ощущению благополучия [9]. В литературе можно найти множество публикаций об эффективности медитации на основе осознанности в лечении депрессии, тревоги, боли и посттравматического стрессового расстройства [8, 9]. Есть также данные о ее эффективности в уменьшении тяжести симптомов, повышении качества жизни и улучшении клинических исходов некоторых хронических заболеваний, таких как гипертензия, диабет, ревматоидный артрит, болезнь Паркинсона, недержание мочи, а также в снижении болевого синдрома [9].
Молекулярный биолог Джон Кабат-Зинн (Jon Kabat-Zinn) впервые стал рассматривать осознанность в научном контексте, когда открыл Клинику лечения стресса при Мемориальном медицинском центре Массачусетского университета в 1979 году [8, 10]. Его программа впоследствии трансформировалась в 8-недельный курс, который прошли уже более 25 тыс. человек [10]. Эта программа, известная как Снижение стресса на основе осознанности (ССОО) (Mindfulness-Based Stress Reduction, MBSR), состоит из еженедельных групповых занятий и самостоятельных упражнений с использованием различных практик медитации, таких как медитация сидя, сканирование тела, йога и медитация во время прогулки [8]. Эта программа интегрирована во многие больничные и внебольничные системы здравоохранения [10].
Позже были разработаны аналогичные программы, например, когнитивная терапия на основе осознанности (КТОО) (Mindfulness-Based Cognitive Therapy, MBCT), адаптация для пациентов с высоким риском рецидива депрессии [11]. Эти программы (ССОО и КТОО) аналогичны по структуре и формату, однако последняя включает принципы когнитивной психотерапии, в рамках которой пациенты учатся разрушать навязчивые и негативные мысли [12]. Эти 2 программы являются методами ТОО с наиболее сильной доказательной базой, представленной публикациями в рецензируемых журналах [13]. Официальные программы ТОО имеют важные общие характеристики, следуют определенным протоколам, что способствует единообразию в подготовке специалистов, реализации программ и проведении исследований [11]. Все большую популярность приобретают электронные адаптации этих программ, онлайн-курсы и приложения, однако они варьируются по длительности, в основном предназначены для самостоятельного использования и не имеют единой структуры [12]. «Медитация любящей доброты» (МЛД) (Loving-Kindness Meditation, LKM) представляет собой стратегию, направленную на выработку сострадания к самому себе, окружающим и миру в целом [13]. Как и осознанность, она помогает усилить концентрацию и сосредоточенность; эти методики часто объединяют как в терапевтической практике, так и в исследованиях [13].
Эффект терапии на основе осознанности в общей популяции
В опубликованной литературе достаточно данных, подтверждающих пользу ТОО в достижении психологического благополучия (табл. 1) [13, 14, 15, 16]. В недавнем метаанализе D. Querstret и соавт. [15] сравнивали ССОО и КТОО с пассивным контролем и установили, что ТОО способствовала значительному снижению навязчивых мыслей, стресса, депрессии и тревожности, а также существенному повышению качества жизни и психологического благополучия. E.E. Burgess и соавт. [16] провели рандомизированное исследование эффективности 5-недельного курса КТОО на обычной популяционной выборке и также обнаружили значительное снижение тревожности, депрессии и беспокойства, причем наибольший эффект был отмечен для беспокойства и депрессии [16]. S.J. Eisendrath и соавт. [14]. оценивали эффект 8-недельной программы КТОО по сравнению с локальной программой укрепления здоровья в сочетании с фармакотерапией у пациентов со стойкой депрессией. В группе КТОО отмечалось выраженное снижение тяжести депрессии и большее число ответивших на терапию, чем среди участников локальной программы. Еще в одном рандомизированном контролируемом исследовании (РКИ), проведенном Y. Wang и соавт. [13], сравнивались КТОО и МЛД с обычной психотерапией. Состояние участников оценивалось через 2, 4, 6 и 8 нед. после завершения курса терапии. В каждой временной точке результаты в группе КТОО/МЛД были лучше, чем в контрольной, и продемонстрировали значительное снижение степени депрессии и руминации по сравнению с исходным уровнем [13]. Во всех временных точках также отмечалось улучшение показателей самооценки и качества жизни [13].
Депрессия и метод осознанности в онкологии
Связь между депрессией и прогнозом онкологического заболевания хорошо задокументирована. Клиническая депрессия увеличивает онкологическую смертность примерно на 39% [7]; при этом даже незначительные депрессивные проявления могут повысить риск на 25% [7]. J. Giese-Davis и соавт. [17] провели рандомизированное исследование женщин с метастатическим раком молочной железы, проходивших групповую терапию, и установили, что те, у кого симптомы депрессии уменьшились через год после лечения, имели существенно более длительную выживаемость (53,6 мес.) по сравнению с теми, у кого депрессия усилилась (25,1 мес.) [17].
Научный интерес к ТОО как к методу лечения депрессии у онкологических больных в последние годы значительно вырос (табл. 2) [19, 20, 21, 22, 23]. Метаанализ, выполненный N. Xunlin и соавт. [23], показал, что у пациентов, участвовавших в сеансах ТОО, значительно снижались тревожность, депрессия, усталость и ощущение стресса; авторы также отмечали повышение качества жизни у всех больных независимо от типа рака [9]. Еще один метаанализ, проведенный L. Cillessen и соавт. [21], продемонстрировал выраженный эффект ТОО в снижении психологического дистресса, тревожности, депрессии, боли и усталости. Хотя в среднем эффект в этом анализе был небольшой, более значительным он отмечен у молодых пациентов, в опытах с более коротким периодом наблюдения, а также в исследованиях с пассивным контролем [21]. В своем анализе E. Kenne Sarenmalm и соавт. [20] рандомизировали женщин в группу ССОО под руководством инструктора, группу самостоятельных занятий ССОО (активный контроль) и группу, в которой вмешательства не проводились. В 2 первых группах отмечалось значительное снижение депрессии по сравнению с группой пассивного контроля [20].
Несколько исследований продемонстрировали смешанные результаты эффективности ТОО. E.R. Nissen и соавт. [22] рандомизировали пациентов с диагнозами «рак молочной железы» и «рак предстательной железы» в 2 группы: группу интернет-программы ССОО и группу ожидания, которая одновременно служила контрольной. Состояние участников оценивалось в исходной точке, через 5 нед., 10 нед. и 6 мес. после начала терапии. Хотя в группе ССОО отмечалось значительное снижение депрессии и тревожности, этот результат не сохранялся через 6 мес. [22]. Эти данные показывают, что для достижения долговременного эффекта необходимо продолжение терапии. РКИ с участием женщин младше 50 лет с диагнозом «рак молочной железы», проведенное J.E. Bower и соавт. [19], показало, что пациентки, прошедшие 6-недельный курс ТОО, отмечали значительное снижение воспринимаемого стресса, астении и нарушений сна, а также более положительное восприятие жизни (положительный аффект) и ощущение умиротворения. Однако существенного снижения симптомов депрессии не наблюдалось. Как и в предыдущем исследовании, эффект терапии не сохранялся спустя 3 мес. наблюдения [17].
Депрессия, нейровоспаление и биомаркеры
В исследованиях по оценке тяжести симптомов депрессии обычно используются стандартные опросники, такие как шкала депрессии Центра эпидемиологических исследований (Hamilton Depression Rating Scale, CES-D) [17, 22], шкала тревоги Бека (Beck Depression Inventory, BDI) [15, 22], Больничная шкала тревоги и депрессии (Hospital Anxiety and Depression Scale, HAD) [14, 20, 21], шкала Гамильтона для оценки депрессии (Hamilton Depression Rating Scale, HAM-D) [16, 24], которые по своей сути являются субъективными. Такая вариабельность создает трудности при сравнении результатов различных исследований. Кроме того, субъективность оценок и невозможность слепой рандомизации при проведении психотерапии создают почву для искажения результатов. Участники могут отмечать снижение симптомов депрессии, поскольку они прошли курс лечения с явной психотерапевтической целью. Однако известно, что уровни некоторых биомаркеров, которые повышаются при воспалительных или хронических заболеваниях, также возрастают и при депрессивных расстройствах. Хотя эти биомаркеры не являются специфическими, их показатели могут сыграть свою роль в качестве дополнения к опросникам при оценке эффективности психотерапевтических вмешательств. Уровни интерлейкина-6 (ИЛ-6), фактора некроза опухолей альфа (ФНО-α) и кортизола повышаются при депрессии [4, 18, 24, 25] и коррелируют с тяжестью симптомов.
ИЛ-6 является гликопротеином, который модулирует иммунную систему в качестве регулятора дифференцировки В-клеток [26]. Постоянное воздействие психологического стресса повышает экспрессию ИЛ-6 иммунными клетками [4]. Этот и другие провоспалительные цитокины пересекают гематоэнцефалический барьер и вызывают нейровоспаление, что влияет на поведение людей [25, 27]. ИЛ-6 связан с вегетативными симптомами и может служить биомаркером депрессии с чувствительностью 79% и специфичностью 87% [4]. Уровень ФНО-α, еще одного воспалительного цитокина, продуцируемого иммунными клетками, также повышается в сыворотке пациентов с большим депрессивным расстройством [3]. Согласно цитокиновой гипотезе депрессии, описанной S.W. Jeon и Y.K. Kim [28], стресс и активация симпатической нервной системы стимулируют высвобождение этих и других цитокинов, которые затем активируют пути, ведущие к деплеции серотонина и других нейромедиаторов, играющих важную роль в стабильности настроения [3, 27, 28].
Помимо активации цитокинов дополнительным механизмом, вовлеченным в нейробиологию депрессии, является нарушение регуляции гипоталамо-гипофизарно-адреналовой (ГГА) оси. Хронический психологический стресс активирует ГГА-ось и симпатическую нервную систему, что приводит к высвобождению глюкокортикоидов, таких как кортизол [4, 25]. Он также уменьшает содержание серотонина, стимулируя его обратный захват [4]. Постоянный стресс и длительное повышение уровня кортизола вызывают неадекватный иммунный ответ, снижая чувствительность иммунных клеток к противовоспалительным механизмам [4, 25]. Таким образом, цитокины и кортизол действуют синергически, способствуя развитию эмоциональной нестабильности.
В нескольких исследованиях подтверждается связь между воспалением и депрессией. В кросс-секционном исследовании мужчин с различными уровнями депрессии (Y. Jia и соавт. [24]) оценивали связь между сывороточным уровнем кортизола, воспалительными цитокинами и депрессией [4]. Было установлено, что участники, страдавшие депрессией, имели гораздо более высокие уровни кортизола и ФНО-α по сравнению с теми, у кого депрессии не было [24]. Эти же исследователи установили, что сывороточные уровни кортизола коррелировали с тяжестью депрессии, что позволило им классифицировать депрессию как легкую, умеренную и тяжелую [24]. S. Heinze и соавт. [29], а также L. Capuron и соавт. [30] продемонстрировали, что пациенты с почечно-клеточным раком или меланомой, получавшие цитокиновую терапию ИЛ-2 или интерфероном-α, имели повышенный риск развития тяжелых симптомов депрессии во время лечения. В других исследованиях отмечено снижение симптомов депрессии у пациентов, прошедших противовоспалительное лечение. R.S. McIntyre и соавт. [31] оценивали эффективность инфликсимаба (анти-ФНО-α моноклонального антитела) в лечении депрессии. По их данным, пациенты, перенесшие детскую травму, сообщили о снижении симптомов депрессии более чем на 50% после 12-недельного курса терапии. Результаты метаанализа O. Kohler-Forsberg и соавт. [32] показали, что противовоспалительные средства, такие как нестероидные противовоспалительные препараты, кортикостероиды, статины и ингибиторы цитокинов, снижают симптомы депрессии как в качестве дополнения к стандартным антидепрессантам, так и в качестве монотерапии. Дополнительная терапия противовоспалительными препаратами также улучшала показатели ответа на лечение и ремиссии по сравнению с плацебо [32].
Воспалительные механизмы при онкологических заболеваниях
Важность значения описанных нейровоспалительных механизмов при депрессии нельзя недооценивать, если учесть роль этих же механизмов в прогрессировании злокачественных опухолей и прогнозе онкологических заболеваний. Существуют убедительные доказательства того, что цитокины и глюкокортикоиды ассоциируются с менее благоприятным прогнозом у больных раком [3, 17, 26, 33, 34, 35, 36, 37]. ИЛ-6 и ФНО-α вовлечены во все стадии развития опухоли, от начала формирования до прогрессирования и метастазирования [35]. Это обусловлено их ролью в проницаемости сосудов, клеточной адгезии и ангиогенезе – процессах, необходимых для роста и распространения опухоли [3, 26, 35, 37, 38].
Нарушение регуляции кортизола может блокировать пути, участвующие в репарации ДНК, и стимулировать рост опухолевых клеток [3]. Кроме того, хроническое повышение уровня глюкокортикоидов и активность симпатической нервной системы, вызванные стрессом, стимулируют сдвиг в сторону выработки миелоидных клеток в костном мозге [4]. Это может объяснить, почему повышенные уровни ИЛ-6, ФНО-α и других цитокинов увеличивают агрессивность острого миелоидного лейкоза [33]. Эти общие для рака и депрессии воспалительные механизмы навели исследователей на мысль о том, что симптомы депрессии часто предшествуют постановке онкологического диагноза [27]. Это явление чаще отмечалось при раке поджелудочной железы и легкого, а также при типах рака, вызывающих злокачественную гиперкальциемию [6].
В нескольких исследованиях продемонстрирована связь между этими биомаркерами и прогнозом онкологического заболевания. G. Tripsianis и соавт. [35] провели лонгитудинальное исследование, в котором оценивались прогноз и характеристики пациентов с диагнозом «рак молочной железы» в связи с уровнями ИЛ-6 и ФНО-α. Высокие уровни ИЛ-6 ассоциировались с лимфоваскулярной инвазией, поздними стадиями и более чем 3 положительными лимфоузлами [35]. Повышенные уровни ФНО-α ассоциировались с теми же характеристиками, а также с низкой дифференцировкой опухоли [35]. И наконец, у пациенток с высокими уровнями ИЛ-6 показатели выживаемости были существенно ниже, чем у пациенток с низким уровнем или отсутствием экспрессии ИЛ-6 (39 мес. vs 62 мес.); аналогичные данные получены для ФНО-α (45 мес. vs 61 мес.) [35].
В другом исследовании, демонстрирующем роль нарушения регуляции ГГА-оси в исходах овариального рака, участники предоставляли образцы слюны для определения содержания кортизола в течение 3 дней до начала терапии и далее находились под наблюдением [36]. Образцы асцитической жидкости для определения ИЛ-6 брали у пациенток с поздними стадиями рака. Повышение уровня ночного кортизола на одно стандартное отклонение ассоциировалось с увеличением риска смерти на 46%, а уровни ИЛ-6 коррелировали с изменениями уровня кортизола [36].
Разрушение тканей вследствие хирургического вмешательства, химиотерапии или облучения приводит к патологическим молекулярным изменениям в поврежденных тканях, стимулируя выработку цитокинов [4, 7]. Ранее обсуждавшиеся виды терапии почечно-клеточного рака и меланомы включают непосредственную инфузию цитокинов для стимуляции разрушения опухоли через воспалительный ответ. [29, 30]. Если противоопухолевая терапия связана с усилением воспалительного ответа, важно рассмотреть дополнительные виды лечения, которые противодействуют этому процессу, не нарушая при этом онколитические механизмы.
Два дополнительных фактора заслуживают включения в любое обсуждение процессов воспаления, депрессии и клинических исходов рака: болевой синдром и социальная изоляция (см. рисунок).
Боль, опиаты и воспаление
По оценкам, до 50% онкологических пациентов испытывают боль в диапазоне от умеренной до сильной [39]. Боль, связанная с онкологическим заболеванием, может быть различной формы, в том числе: острой, которая ассоциируется непосредственно с лечением (хирургическая операция, химиотерапия, облучение); хронической, связанной с прогрессированием опухоли, продолжением терапии или ранее существовавшим болевым синдромом; обусловленной наличием наркозависимости в анамнезе; сопровождающей терминальную стадию болезни [40].
Как сама боль, так и обычные методы ее лечения способствуют провоспалительному состоянию. Боль запускает стрессовый ответ через дисфункцию ГГА-оси и избыточную секрецию глюкокортикоидов, стимулируя иммуносупрессию и прогрессирование опухоли [41]. Опиаты давно стали основным видом лечения всех видов боли, связанной с онкологическими заболеваниями [39, 41]. Одной из проблем, возникающих при длительном применении опиатов, является привыкание, или снижение эффективности, что требует постоянного повышения дозы для поддержания терапевтического эффекта [42].
Воспалительные механизмы толерантности к опиатам хорошо описаны в литературе [42, 43, 44]. Опиаты связываются с гликопротеинами на толл-подобном рецепторе 4, иммунном рецепторе, находящемся на микроглии [42, 43, 44]. Этот сигнальный путь активирует воспалительный ответ, который приводит к высвобождению цитокинов, включая ФНО, ИЛ-1 и ИЛ-6 [42, 43, 44]. Роль этих цитокинов в нейровоспалении и применении опиатов очень сложна, но их высвобождение экспоненциально возрастает при длительном приеме опиатов и приводит к повышению активности болевых рецепторов, способствуя развитию толерантности [42].
Помимо негативных эффектов воспаления, описанных выше, существуют и другие опасения, связанные с постоянным приемом опиатов и развитием толерантности к ним у онкологических больных. Доклинические и ретроспективные исследования указывают на возможную связь между использованием опиатов и метастазированием или прогрессированием опухоли [41, 45]. Возможные механизмы включают активацию μ-опиатных рецепторов на злокачественных клетках, стимуляцию клеточной пролиферации и ангиогенеза [41]. Было показано, что некоторые опиаты ингибируют активность и цитотоксичность иммунных клеток [41]. Примечательно, что в нескольких ретроспективных исследованиях было показано, что прием опиатов связан со снижением продолжительности жизни при нескольких видах рака [46, 47, 48, 49], но эта связь не нашла подтверждения в проспективных клинических исследованиях, поэтому опиаты остаются основным компонентом лечения болевого синдрома при онкологических заболеваниях [41, 45, 50, 51]. Тем не менее воспалительный характер боли и использование опиатов для ее купирования требуют дальнейшего изучения их потенциальной роли в развитии депрессии и неблагоприятных клинических исходах. Кроме того, существуют опасения относительно побочных эффектов опиатов у онкологических пациентов, в том числе осложнений со стороны желудочно-кишечного тракта, риска развития зависимости, незаконной передачи/продажи препаратов другим людям или их передозировки [40].
Социальная изоляция
Хорошо известно, что социальная изоляция ассоциируется с депрессией и высоким уровнем психологического дистресса [52, 53]. В данном обзоре мы уже рассмотрели влияние психологического дистресса на механизмы воспаления и прогноз онкологического заболевания. Исследования на животных и людях дают дополнительную информацию о влиянии социальной изоляции на прогрессирование рака и онкологическую выживаемость через воспалительные механизмы. В многочисленных исследованиях у подвергнутых социальной изоляции мышей отмечены клеточные изменения, способствующие прогрессии опухоли, включая ангиогенез, генную экспрессию, а также нейроэндокринный и иммунный ответы [54, 55]. В крупном кросс-секционном исследовании, проведенном S. Hafner и соавт. [56], обнаружено синергическое влияние депрессии и социальной изоляции на уровни ИЛ-6 и С-реактивного белка у мужчин. Результаты проспективных групповых исследований демонстрируют связь между ограниченными социальными связями или слабой социальной поддержкой и онкологической выживаемостью. В литературе социальная поддержка определяется как наличие друзей, детей, близких родственников [57] или кого-то, с кем можно поговорить о своем заболевании и личных проблемах [58]. По данным C. Kroenke и соавт. [57], среди женщин с диагнозом «рак молочной железы» смертность от любых причин была выше на 66%, а от рака выше вдвое, если они имели низкую социальную поддержку. В метаанализе M. Pinquart и P. Duberstein [59] высокий уровень воспринимаемой социальной поддержки, обширные социальные связи и наличие семьи у онкологических больных ассоциировались с более низкой смертностью. Другие исследования показали аналогичные результаты [58, 60]. Вполне вероятно, что эта взаимосвязь обусловлена недостатком помощи в тех случаях, когда она необходима (обеспечение лекарствами, сопровождение на прием к врачу и т. д.). Риск смерти может усугубляться реактивностью ГГА-оси и нейровоспалением, связанными с психосоциальным стрессом. Эти механизмы остаются умозрительными, а известные ассоциации между социальной изоляцией, стрессом и смертностью от рака заслуживают более пристального внимания.
Концепция осознанности, воспаление, боль и социальное функционирование
Недавние публикации демонстрируют интерес к терапии на основе осознанности (табл. 3) [19, 20, 38, 61, 62, 63]. C.A. Lengacher и соавт. [38] изучали влияние 6-недельной программы ССОО на уровни кортизола и ИЛ-6 в слюне пациенток, перенесших рак молочной железы. Результаты этого РКИ показали положительный кратковременный эффект с существенным снижением обоих маркеров сразу же после терапии, через 1 нед. и 6 нед. (по сравнению с уровнями непосредственно перед началом лечения) [38]. Однако они не продемонстрировали значительной разницы между уровнями исходными и на 6-й нед. после терапии [38]. Авторы отмечают, что более ранние исследования показали противоречивые результаты; в некоторых снижение маркеров с течением времени было значительным, в других оно отсутствовало [38]. Еще одно РКИ, проведенное E.A. Hoge и его соавт. [62], оценивало уровни адренокортикотропного гормона (АКТГ), кортизола, ИЛ-6 и ФНО-α до и после 8-недельного курса ССОО у взрослых пациентов с генерализованным тревожным расстройством. Уровни АКТГ, ИЛ-6 и ФНО-α снизились в группе ССОО после 8 нед. терапии, в то время как в контрольной группе все эти показатели возросли [62]. Не было отмечено изменений уровня кортизола по сравнению с контрольной группой; это свидетельствует о том, что АКТГ, по-видимому, является более чувствительным показателем дисфункции ГГА-оси, чем кортизол [62]. Одно раннее РКИ, проведенное E. Walsh и совт. [61], продемонстрировало значительное снижение ИЛ-6 и ФНО-α у женщин с депрессией, прошедших 5-недельный курс ТОО, по сравнению с контрольной группой. Сниженные уровни ИЛ-6 сохранялись на протяжении 3 мес., причем более выраженный эффект был отмечен у пациенток с более сильной исходной депрессией [61]. И, наконец, в результате недавнего метаанализа 10 исследований применения ТОО у пациентов с психическими расстройствами, выполненного K. Sanada и соавт. [63], установлено, что методы ТОО привели к значительному снижению уровней кортизола, ИЛ-6 и ФНО-α.
ТОО также продемонстрировала умеренный потенциал в качестве опции для лечения боли и повышения уровня воспринимаемой социальной поддержки 2 факторов, ассоциирующихся с воспалением и вероятной выживаемостью (табл. 4) [39, 64, 65, 66, 67]. S. Ngamkham и соавт. [39] в систематическом обзоре отметили, что ТОО привела к статистически значимому снижению интенсивности боли в 4 из 6 включенных в обзор исследованиях. Авторы предполагают, что ТОО помогает отвлекать внимание от неприятных симптомов, повышая тем самым толерантность к боли [39]. Другие данные, представленные в этом обзоре, свидетельствуют о том, что некоторую роль также может играть снижение воспаления; следовательно, дополнительным положительным эффектом может быть снижение привыкания к опиатам.
Данные метаанализа 30 РКИ, выполненного L. Hilton и соавт. [64], продемонстрировали небольшое преимущество ТОО в лечении хронической боли по сравнению с обычными методами, группами пассивного контроля и образовательными группами / группами поддержки. Только в 4 исследованиях, включенных в этот метаанализ, сообщалось об употреблении пациентами анальгетиков после лечения, но результаты были неоднозначными, поскольку в 2 из этих исследований было отмечено уменьшение дозы обезболивающих после ТОО [64].
Еще один недавний метаанализ (B. Feng и соавт. [66]) показал, что ТОО ассоциировалась со значительным снижением интенсивности боли у онкологических больных как в краткосрочной, так и в более длительной перспективе, хотя эффект был достаточно невысоким. Улучшение было более выраженным у пациентов, посещавших очные сеансы, по сравнению с пациентами, занимавшимися онлайн [66]. Однако нельзя полностью отрицать эффект ТОО посредством интернет-приложений. J. Mascaro и соавт. [65] провели РКИ для оценки эффективности самостоятельного использования пациентами интернет-приложения в течение 6 недель в плане снижения интенсивности и катастрофизации боли. Участники исследования, использовавшие приложение, сообщили о снижении ощущения беспомощности по шкале катастрофизации боли (Pain Catastrophizing Scale, PCS) [65]. В то же время участники группы ТОО не отметили существенных изменений интенсивности боли, что могло быть результатом недостаточной приверженности рекомендациям приложения относительно длительности и частоты занятий. Интересно, что участники группы ТОО сообщили об ухудшении физических функций и одновременно об улучшении социального функционирования [65].
Хотя социальная изоляция ассоциируется с повышенной онкологической смертностью, ТОО как социальное вмешательство анализировалась мало. В обзоре исследований, изучавших роль вмешательств в снижении чувства одиночества, N. Veronese и соавт. [67] охарактеризовали ТОО и медитацию как положительные факторы, однако их выводы были основаны только на результатах 2 исследований и имели низкое качество доказательств. ТОО может снижать синдром навязчивых мыслей, вызывающий ощущения одиночества и изоляции [68]. Групповая ТОО может способствовать формированию чувства общности у людей, страдающих от социальной изоляции. Исследования этой проблемы ограничены и должны быть продолжены для достижения лучшего понимания социальных преимуществ ТОО, особенно для онкологических пациентов, в значительной степени зависящих от их социального окружения.
Обсуждение
В этом обзоре мы анализируем связь между депрессией, воспалением и прогнозом онкологических заболеваний, а также пользу ТОО в лечении депрессии у онкологических больных (см. рисунок). Данные свидетельствуют о том, что когнитивная терапия на основе осознанности помогает в лечении депрессии, поскольку направлена на те же воспалительные механизмы, которые коррелируют с ухудшением онкологического прогноза. Также может иметься непрямой противовоспалительный эффект, связанный с уменьшением боли и улучшением социального функционирования. Кроме того, если и депрессия, и воспаление обратно коррелируют с выживаемостью, ТОО может способствовать продлению жизни и повышению ее качества.
Несмотря на полученные данные, текущие исследования имеют ряд недостатков. Например, в обзоре, посвященном достоверности данных по ТОО с использованием рекомендаций Консорциума по изменению поведения (National Institutes of Health Behavior Change Consortium), A. Kechter и соавт. [69] установили, что только 12% исследований эффективности ТОО среди взрослых участников подтвердили достоверность лечения. Кроме того, существуют различия в качестве программ ТОО в зависимости от уровня подготовленности и опыта инструкторов и содержания сеансов. A. Lutz и соавт. [70] описали различия в содержании в зависимости от того, обучала ли программа фокусировке внимания (концентрация на определенном ощущении, звуке или образе) или открытому мониторингу (расширение поля внимания без фокусировки, затем плавное отключение внимания, не сопровождающееся оценкой). И наконец, поскольку многие программы ТОО относительно краткосрочные и отсутствует длительный последующий мониторинг, есть данные о том, что первоначально практики ТОО могут способствовать дисфорическому аффекту из-за повышенного внимания к внутренним мыслям и эмоциям, что может привести к неоднозначным результатам в оценке симптомов депрессии [71].
Тем не менее научные знания о преимуществах ТОО продолжают накапливаться и распространяться, и все больше онкологических центров включают ТОО в интегративные психосоциальные программы. Растущий интерес к ТОО, как мы надеемся, будет стимулировать дальнейшие исследования, поскольку пока нет окончательных достоверных данных о влиянии ТОО на выживаемость. Кроме того, в большинстве исследований не проводилась отдаленная оценка клинических симптомов и воспалительных маркеров после терапии; самый длительный период прослеживания составил 6 мес., причем в этом случае пациентов просили самостоятельно продолжать занятия, что является проблематичным. Неясно также, дают ли самостоятельные и менее интенсивные занятия тот же самый эффект, что и кратковременные курсы интенсивной терапии, результат которых оценивался в проведенных исследованиях.
Помимо этого, существуют также некоторые барьеры, которые следует принимать во внимание при включении ТОО в схемы лечения онкологических заболеваний. Пациенты могут испытывать некоторые сомнения по поводу участия в таких программах, поскольку не видят прямой связи этих занятий и упражнений со своим заболеванием или лечением. Режим лечения рака и так является интенсивным, и пациенты могут не желать усложнять его еще больше. В некоторых случаях регулярным занятиям может препятствовать длительная госпитализация, хотя сегодня использование телемедицины помогает решить эту проблему. Подобные программы требуют участия квалифицированных специалистов, которые не всегда есть в штате крупных академических центров; эта задача может быть решена на уровне местных медицинских учреждений. Кроме того, хотя некоторые страховые компании рассматривают такие вмешательства как групповую психотерапию и включают в страховое покрытие, эти программы могут быть слишком дорогостоящими для лиц, не имеющих страховки. И наконец, следует устранить пробелы в использовании программ с учетом пола, образовательного уровня и культурной среды пользователей. Это положение основано на данных о том, что мужчины вдвое реже прибегают к ТОО, чем женщины [72]. Лица с более низким уровнем образования также менее склонны использовать такие практики, и в первую очередь это касается афро- и латиноамериканцев в основном из-за стигматизации и ограниченной доступности, а также тенденции американских программ ТОО игнорировать культурные особенности пользователей [72, 73].
Имеющиеся публикации демонстрируют потенциал ТОО в качестве медицинского вмешательства, направленного на продление жизни онкологических больных. Исследования в этой области быстро развиваются, и в перспективе усилия должны быть сфокусированы на лонгитудинальных РКИ, чтобы как можно более объективно оценить влияние ТОО на выживаемость онкологических больных, а также на уровень депрессии, боли, воспаления и социального функционирования как промежуточных переменных.
- Введение
- История и обзор концепции и метода осознанности
- Эффект терапии на основе осознанности в общей популяции
- Депрессия и метод осознанности в онкологии
- Депрессия, нейровоспаление и биомаркеры
- Воспалительные механизмы при онкологических заболеваниях
- Боль, опиаты и воспаление
- Социальная изоляция
- Концепция осознанности, воспаление, боль и социальное функционирование
- Обсуждение

Таблица 1. Общие исследования терапии на основе осознанности (краткая информация об исследованиях, в которых оценивались мероприятия по осознанности среди населения в целом)
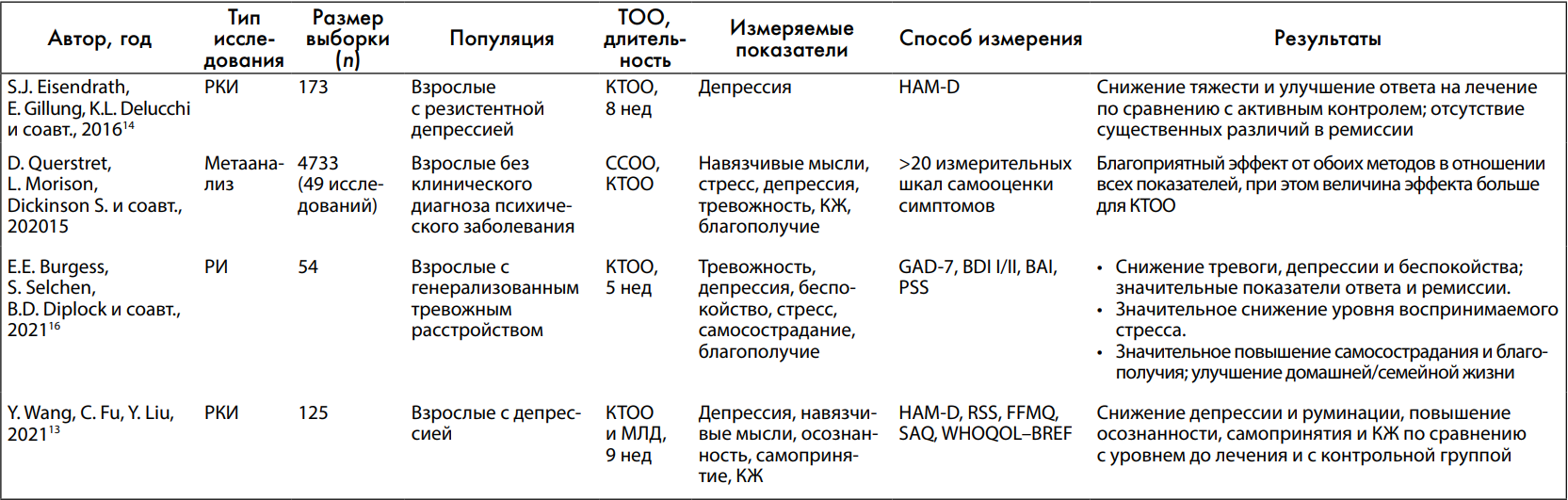
Сокращения: BAI (Beck Anxiety Inventory) – шкала тревоги Бека; BDI I/II (Beck Depression Inventory I and II) – шкала депрессии Бека I и II; FFMQ (Five-Faceted Mindfulness Questionnaire) – пятифакторный опросник осознанности; GAD-7 (Generalized Anxiety Disorder-7) – шкала генерализованного тревожного расстройства 7; HAM-D (Hamilton Depression Rating Scale) – шкала Гамильтона для оценки депрессии; PSS (Perceived Stress Scale) – шкала воспринимаемого стресса; RSS (Ruminative Responses Scale) – шкала-вопросник по руминации; SAQ (Self-Acceptance Questionnaire) – опросник самооценки; WHOQOL–BREF (World Health Organization Quality of Life Brief Form) –опросник ВОЗ для оценки качества жизни (краткий); ВОЗ – Всемирная организация здравоохранения; КЖ – качество жизни; КТОО – когнитивная терапия на основе осознанности; МЛД – медитация любящей доброты; РИ – рандомизированное исследование; РКИ – рандомизированное контролируемое исследование; ССОО – снижение стресса на основе осознанности; ТОО – терапия на основе осознанности.
Выходные данные исследований представлены в первоисточнике.
Таблица 2. Исследования терапии на основе осознанности у онкологических больных: депрессия и благополучие (краткая информация об исследованиях, оценивающих мероприятия по осознанности у пациентов с раком и первичные результаты, связанные с депрессией и благополучием)
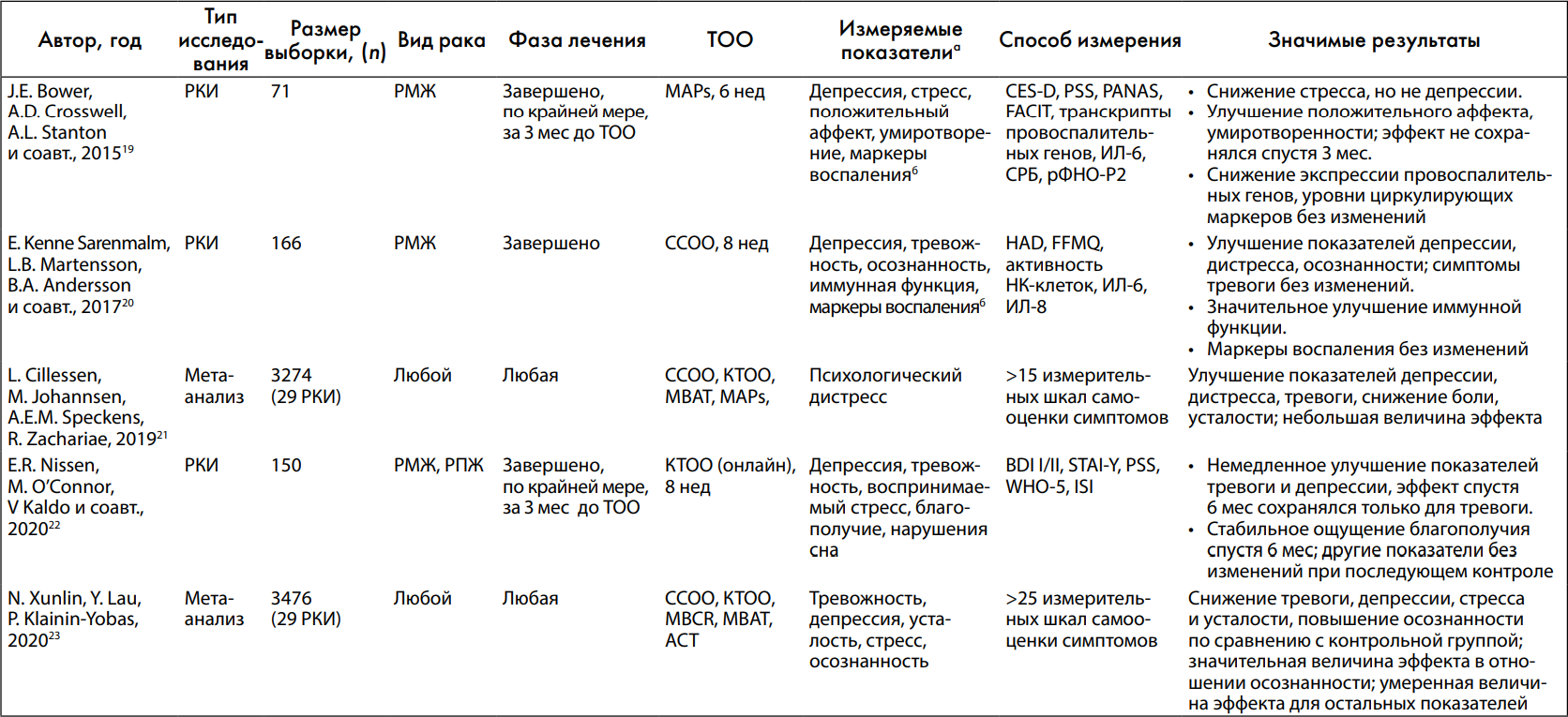
а Первичные результаты включены для всех исследований, вторичные результаты перечислены не все.
б См. также табл. 3.
Сокращения: ACT (Acceptance and Pledge Therapy) – терапия принятия и ответственности; BDI I/II (Beck Depression Inventory I and II) – шкала депрессии Бека I и II; CES-D (Hamilton Depression Rating Scale) – шкала депрессии Центра эпидемиологических исследований; FACIT (Functional Assessment of Chronic Illness Therapy) – функциональная оценка терапии хронических болезней; FFMQ (Five-Faceted Mindfulness Questionnaire) – пятифакторный опросник осознанности; HAD (Hospital Anxiety and Depression Scale) – Больничная шкала тревоги и депрессии; ISI (Insonia Severity Index) – индекс тяжести бессонницы; MAPs (Mindful Awareness Practices) – практики осознанного внимания; MBAT (Mindfulness-Based Art Therapy) – арт-терапия на основе осознанности; MBCR (Mindfulness-Based Care And Recovery) – лечение и восстановление на основе осознанности; PANAS (Positive and Negative Affect Scale) – шкала позитивного и негативного аффекта; PSS (Perceived Stress Scale) – шкала воспринимаемого стресса; STAI-Y (State-Trait Anxiety Inventory form Y) – шкала тревоги Спилбергера; WHO-5 – индекс благополучия ВОЗ 5; ВОЗ – Всемирная организация здравоохранения; ИЛ – интерлейкин; КТОО – когнитивная терапия на основе осознанности; НК – натуральные киллеры; РКИ – рандомизированное контролируемое исследование; РМЖ – рак молочной железы; РПЖ – рак предстательной железы; рФНО-Р2 – растворимый фактор некроза опухолей, рецептор 2; СРБ – С-реактивный белок; ССОО – снижение стресса на основе осознанности; ТОО – терапия на основе осознанности; ЦЭИ – Центр эпидемиологических исследований.
Выходные данные исследований представлены в первоисточнике.
Таблица 3. Исследования терапии на основе осознанности и маркеров воспаления (краткая информация об исследованиях, оценивающих основанные на осознанности вмешательства и воспаление в качестве основного результата)ª
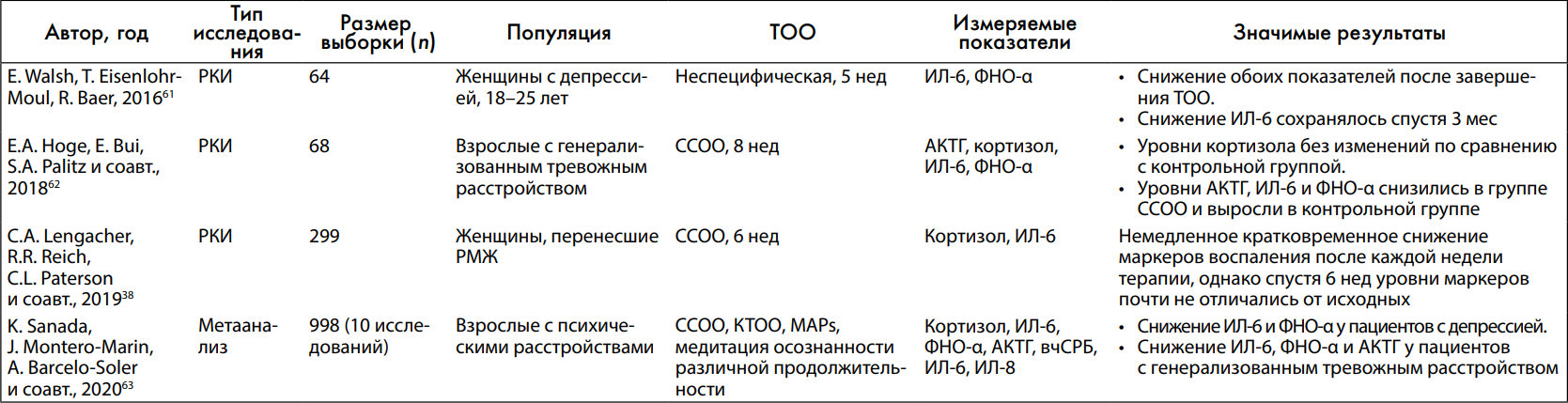
а См. Также: табл. 2, J.E. Bower, A.D. Crosswell, A.L. Stanton и соавт., и E. Kenne Sarenmalm, L.B. Martensson, B.A. Andersson и соавт.
Сокращения: MAPs (Mindful Awareness Practices) – практики осознанного внимания; АКТГ – адренокортикотропный гормон; вчСРБ – высокочувствительный С реактивный белок; ИЛ – интерлейкин; КТОО – когнитивная терапия на основе осознанности; РКИ – рандомизированное контролируемое исследование; РМЖ – рак молочной железы; ССОО – снижение стресса на основе осознанности; ТОО – терапия на основе осознанности; ФНО-α – фактор некроза опухолей альфа.
Выходные данные исследований представлены в первоисточнике.
Таблица 4. Исследования терапии на основе осознанности и показателей боли и социального функционирования (краткая информация об исследованиях, в которых оцениваются направленные на осознанность вмешательства для улучшения боли и социального функционирования)
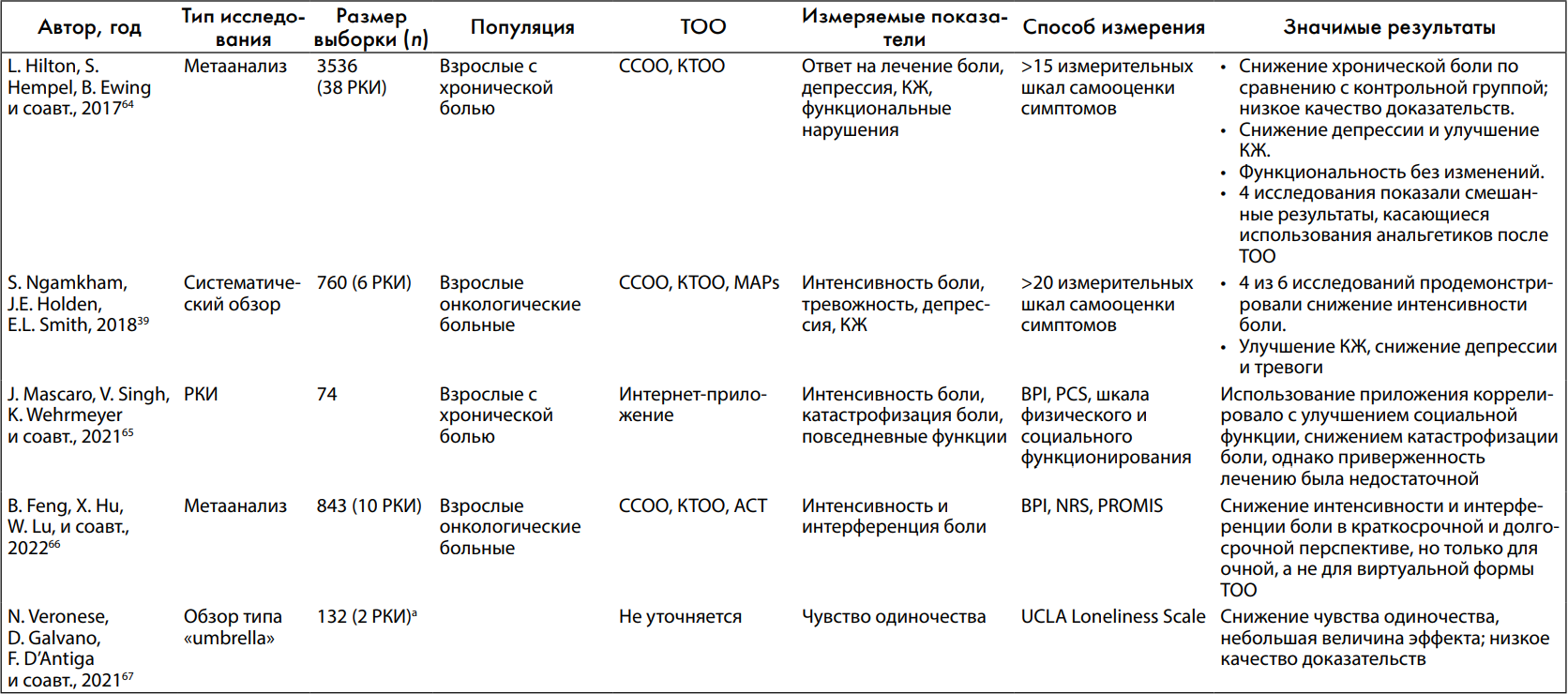
a Только 2 исследования в этом обзоре использовали ТОО в качестве медицинского вмешательства, следовательно, здесь представлена только 1 выборка.
Сокращения: ACT (Acceptance and Pledge Therapy) – терапия принятия и ответственности; BPI (Brief Pain Inventory) – краткий опросник боли; MAPs (Mindful Awareness Practices) – практики осознанного внимания; NRS (Numeric Rating Scale for Pain) – числовая шкала для оценки боли; PCS (Pain Catastrophizing Scale) – шкала катастрофизации боли; PROMIS (Patient Reported Outcomes Measurement Information System) – информационная система самооценки пациентами результатов медицинских вмешательств; UCLA (University of California-Los Angeles) Loneliness Scale – шкала оценки одиночества Калифорнийского университета; КЖ – качество жизни; КТОО – когнитивная терапия на основе осознанности; РКИ – рандомизированное контролируемое исследование; ССОО – снижение стресса на основе осознанности; ТОО – терапия на основе осознанности.
Выходные данные исследований представлены в первоисточнике.



















