
Введение
Колоректальный рак (КРР) является одним из наиболее распространенных злокачественных новообразований в популяции (2-е место по распространенности у женщин и 3-е – у мужчин) [1], что обусловливает необходимость скрининга данной патологии. Под скринингом понимают использование тестов или процедур для раннего выявления заболевания у асимптомных пациентов [2].
В настоящее время наиболее часто в качестве скрининга КРР используют тестирование кала на скрытую кровь и эндоскопические методы (такие как сигмоскопия и колоноскопия). Согласно данным M. Bretthauer и соавт. [3], относительный риск смерти от КРР на 15 % ниже у пациентов, прошедших тестирование кала на скрытую кровь, однако данный метод скрининга не может влиять на риск возникновения этого заболевания. Поскольку в большинстве случаев КРР регистрируется при малигнизации доброкачественных полипов, которые могут быть обнаружены и удалены при эндоскопическом исследовании, этот метод исследования способствует предотвращению его развития. Также важным преимуществом эндоскопических методов является возможность проведения биопсии с последующей гистологической верификацией.
На данный момент в Российской Федерации в рамках первого этапа диспансеризации взрослого населения (от 49 до 75 лет) 1 раз в 2 года проводится исследование кала на скрытую кровь иммунохимическим методом (ИГХ). При положительном результате пациенту выполняется колоноскопия или ирригография с двойным контрастированием [4].
Колоректальный рак является единственным видом рака, для которого разработан скрининг, позволяющий снизить смертность от данной патологии среди мужчин и женщин со средней степенью риска [5]. Таким образом, увеличение охвата населения программой скрининга КРР, а также своевременное выполнение полипэктомии позволяют предотвратить развитие этого заболевания [2, 6].
Цель исследования – оценка результатов скрининговой колоноскопии с одномоментным удалением доброкачественных эпителиальных образований в амбулаторных условиях при помощи «холодных» методов, а также ее эффективности в профилактике КРР.
Материалы и методы
Данная работа представляет собой ретроспективное исследование, основанное на анализе результатов колоноскопии, выполненной в амбулаторных условиях – в ГАУЗ «Городская клиническая больница им. Н.И. Пирогова» (Оренбург) за 2018–2021 гг. В программу скрининга КРР включены пациенты, проживающие на прикрепленной к учреждению территории. К скринингу привлекались асимптомные пациенты от 50 до 75 лет без отягощенного семейного анамнеза, факторов риска, с положительными результатами ИГХ исследования кала на скрытую кровь, назначенного по программе диспансеризации.
Критерии исключения из программы скрининга:
- возраст менее 50 или более 75 лет;
- наличие клинических симптомов заболевания кишечника;
- наличие семейных или индивидуальных факторов риска.
В качестве стандартной двухэтапной схемы подготовки к колоноскопии пациенты принимали препараты Фортранс® или Эзиклен®. Качество подготовки к исследованию оценивалось по Бостонской шкале. Видеоколоноскопия выполнялась в амбулаторных условиях 2960 (64,5 %) пациентам без седации, 1628 (35,5 %) – с внутривенной седацией. Исследования проводились видеоколоноскопами Olympus CF-Q150L с использованием видеосистемы CV-150.
Выявленные во время колоноскопии образования классифицировались на:
- мельчайшие (<5 мм) – удалялись биопсийными щипцами с дальнейшим гистологическим исследованием,
- мелкие (<10 мм) – удалялись методом эндоскопической резекции слизистой (endoscopic mucosal resection, EMR) при помощи «холодной» петли также с последующим гистологическим исследованием.
- Пациентам со средними (25 мм) образованиями во время скрининговой колоноскопии выполняли щипцовую биопсию. В случае подтверждения доброкачественности образования вследствие гистологической верификации проводилась последующая эндоскопическая полипэктомия с применением электрохирургии в условиях стационара.
Во время исследования все образования типов 0–Is и 0–IIa по Парижской классификации, не имеющие изменений рельефа слизистой и капиллярного рисунка, диаметром <10 мм удаляли во время скрининговой колоноскопии «холодными» методами.
При проведении исследования оценивались частота выявления аденом (adenoma detection rate, ADR) и частота выявления полипов (polyp detection rate, PDR). Также проведен анализ других показателей качества выполненной колоноскопии (качество подготовки к процедуре по Бостонской шкале, время выведения колоноскопа).
Статистическая обработка полученных данных заключалась в проведении статистического наблюдения с формированием репрезентативной выборки пациентов, прошедших скрининговую колоноскопию в амбулаторных условиях с последующей обработкой в программе Excel. Была сформирована целевая группа, а также осуществлены сводка и группировка больных по полу, возрасту, качеству подготовки к процедуре по Бостонской шкале, локализации новообразования, типу полипов по Парижской классификации, их размеру и гистологическому заключению. Выявлены основные зависимости и корреляции, которые были в дальнейшем проанализированы. Результаты считались статистически значимыми при p <0,05.
Результаты
За период 2018–2021 гг. выполнены 4588 скрининговых колоноскопий (рис. 1). Доля пациентов, принявших участие в скрининге, относительно общего числа приглашенных составила 67,6 %.
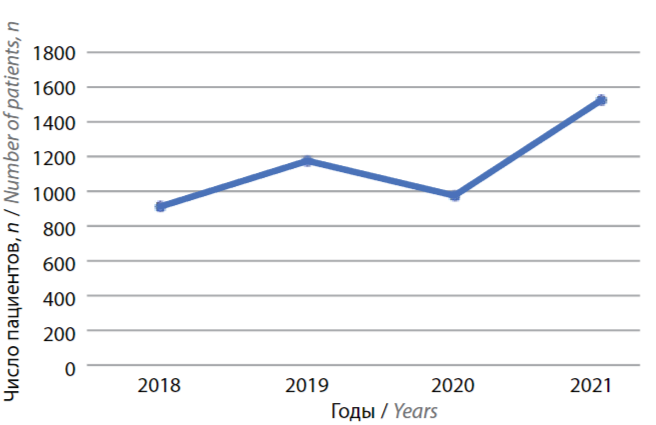
Рис. 1. Число выполненных скрининговых колоноскопий за время проведения исследования (2018–2021 гг.)
Среди обследованных пациентов были 2378 (51,8 %) женщин и 2210 (48,2 %) мужчин. Возраст больных составил 50–75 лет, средний возраст – 57,6 года. В 82 % случаев колоноскопия выполнялась пациентам с положительным результатом ИГХ-анализа кала на скрытую кровь.
Подготовка к проведению колоноскопии оценивалась по Бостонской шкале; доля пациентов с адекватной подготовкой составила 92 %. Частота достижения купола слепой кишки оказалась равной 96 %. Основной причиной неадекватной интубации кишечника явилась спаечная болезнь брюшной полости, развившаяся в результате неоднократных полостных операций.
Среднее время выведения колоноскопа составило 9,8 ± 1,3 мин без учета времени, которое было затрачено на биопсии и полипэктомии. Значения ADR и PDR представлены на рис. 2.
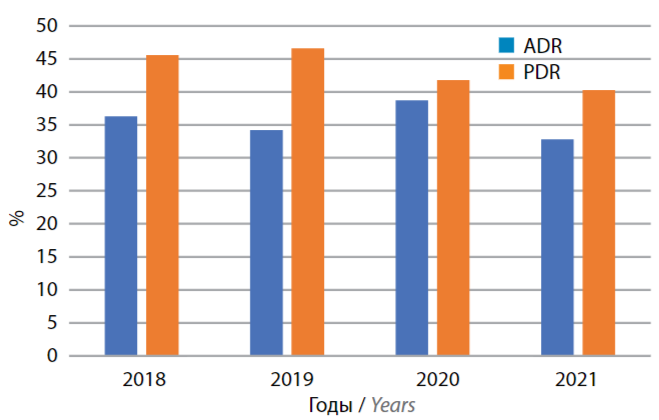
Рис. 2. Значения частоты выявления аденом (adenoma detection rate, ADR) и частоты выявления полипов (polyp detection rate, PDR), полученные в результате исследования
За 2018–2021 гг. было удалено 1041 образование, из них 456 (44 %) – биопсийными щипцами, 585 (56 %) – холодной петлей единым блоком. В 622 (59,7 %) случаях макроскопическая форма образований была плосковозвышенной (тип 0–IIа), в 326 (31,3 %) – полиповидной (тип 0–Is). При этом в 93 (9 %) образованиях определялся участок депрессии (тип Iia + IIc).
По результатам гистологического исследования зубчатый тип строения диагностирован в 158 (15,2 %) случаях, незубчатый – в 883 (84,8 %). У276 (26,5 %) пациентов выявлены и удалены аденомы с микроочагами аденокарциномы (tumor in situ). В результате гистологического исследования уровень их инвазии по классификации Haggitt ограничивался I–II степенью, что свидетельствовало о радикальности удаления.
За период исследования (2018–2021 гг.) наблюдалось 1 (0,09 %) осложнение амбулаторной полипэктомии, выполненной методом EMR холодной петлей, которое проявилось незначительным кровотечением, купированным самостоятельно, но потребовавшим госпитализации пациентки для динамического наблюдения. С целью плановой полипэктомии госпитализированы больные, у которых обнаружены полипы типа 0–Is размером >10 мм в диаметре, а также типа 0–Ip и стелющиеся образования (laterally spreading tumor, LST): 111 (12 %) случаев из них – в 2018 г., 165 (13 %) – в 2019 г., 89 (8,9 %) – в 2020 г., 116 (7,6 %) – в 2021 г. Этой группе пациентов в стационаре выполнена полипэктомия методом EMR горячей петлей (с применением электрокоагуляции).
За 2018–2021 гг. при проведении скрининговой колоноскопии выявлены 227 (4,9 %) случаев КРР (рис. 3). Гистологически были обнаружены аденокарциномы различной степени дифференцировки (93,3 % случаев) и плоскоклеточный неороговевающий рак (6,7 % случаев). Пациенты с гистологически выявленным КРР для последующего лечения были направлены к онкологу.
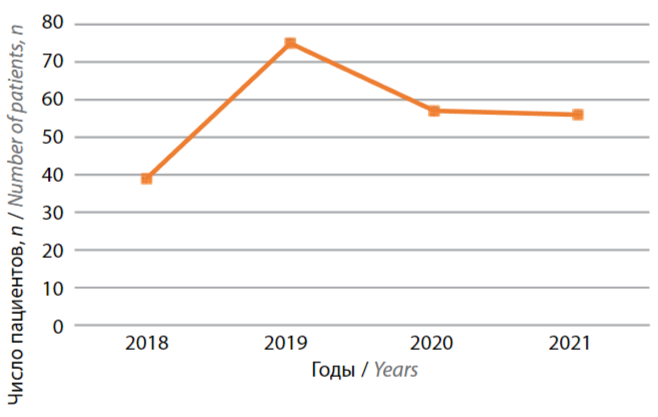
Рис. 3. Число случаев колоректального рака, выявленных в процессе исследования за 2018–2021 гг.
В результате анализа локализации выявленных случаев КРР, аденом и полипов (табл. 1) мы пришли к выводу, что чаще они обнаруживаются в толстой кишке, чем в прямой (р = 0,037).
Для оценки целесообразности проведения скрининга КРР асимптомным пациентам без факторов риска с 50 лет мы провели анализ всех обнаруженных во время исследования случаев КРР, аденом и полипов в зависимости от возраста больных (табл. 2). Полученные данные (p = 0,046) подтверждают более частую выявляемость КРР у пациентов старше 50 лет и обусловливают необходимость начала выполнения скрининговых исследований с 50 лет.
Обсуждение
Полученные нами результаты подтверждаются исследованиями других авторов [7–9]. Выявлено, что колоноскопия, в ходе которой обнаруживают и удаляют как минимум одну аденому размером >5 мм, приводит к снижению заболеваемости КРР на 80 % после 10-летнего периода наблюдения [9–11]. Многочисленные данные подтверждают необходимость применения колоноскопии как скринингового метода выявления КРР у асимптомных пациентов [12, 13]. Также техника проведения данного исследования позволяет достичь радикального удаления аденом с микроочагами аденокарциномы и предупредить дальнейшее прогрессирование КРР.
В результате оценки основных показателей эффективности выполнения колоноскопии были определены показатели ADR и PDR. Частота выявления аденом за все время исследования была выше 25 %, что доказывает высокое качество осмотра слизистой кишки. Частота выявления полипов более 40 % также указывает на высокое качество выполнения исследования. Полученные данные подтверждают частую встречаемость аденом и полипов среди населения старше 50 лет, доказывают значительную эффективность колоноскопии как скринингового метода, а также высокое качество ее выполнения при проведении исследования в лечебном учреждении. Среднее время выведения колоноскопа 9,8 ± 1,3 мин соответствует принятым стандартам (6–10 мин). Частота достижения купола слепой кишки в исследовании (96 %) также соответствует стандартам (не ниже 95 %) [14].
Обеспокоенность более частым развитием осложнений (повреждение сосудистых структур и стенки кишки) в результате полипэктомии с применением электрокоагуляции вызвала большой интерес к «холодным» методам полипэктомии [15]. По данным R. Ortigão, J. Weigt и соавт., полная резекция полиповидных образований холодной петлей была достигнута в 99,3 % случаев; в последующих колоноскопиях частота развития рецидивов составила 4,1 % [15]. Исследования этих авторов [15] показали низкий процент осложнений при проведении полипэктомии «холодным» методом. Перфораций при удалении образований толстой кишки данным способом не наблюдалось, поскольку отсутствовало термическое повреждение стенки кишки. Высокая безопасность этой методики подтверждается результатами нашего исследования: число осложнений составило 0,09 % (р = 0,25).
В связи с тем, что полипэктомия методом холодной петли характеризуется низкой вероятностью развития осложнений, данную манипуляцию можно считать методом выбора для проведения в амбулаторных условиях. Также она не требует госпитализации и позволяет осуществить одномоментное проведение диагностической и лечебной процедуры, вследствие чего легче переносится пациентами. Полипэктомия с одновременным удалением эпителиальных образований является экономически более выгодной, так как нет дополнительной нагрузки на оборудование и необходимости в проведении повторного наркоза. Однако полипэктомия методом холодной петли имеет и недостатки: из-за отсутствия необходимости госпитализации невозможно проводить динамическое наблюдение за больными. Также с помощью этой техники нельзя удалить полипы больших размеров, а врач не всегда может провести одномоментное удаление образования, поскольку периодически возникает необходимость гистологической верификации.
Риск развития КРР повышается с увеличением возраста пациента и при наличии данной патологии в семейном анамнезе. Частота выявления рака увеличивается после 50 лет и удваивается каждое десятилетие. В связи с этим рекомендуемый возраст начала скрининговой колоноскопии составляет 50 лет. Кроме того, это исследование нужно проводить каждые 10 лет при отсутствии в семейном анамнезе КРР. Лица, у которых в семейном анамнезе есть КРР или аденоматозные полипы, должны подвергаться скрининговой колоноскопии с 40 лет; частота повторения скрининга – не реже 1 раза каждые 5 лет. Пациентам с синдромом Линча необходимо проводить колоноскопию каждые 1–2 года [12, 13].
Для более эффективной профилактики КРР в России на основании данных, полученных в результате нашего исследования, с целью индивидуального определения возраста начала скрининга и наиболее верной тактики диагностики в зависимости от факторов риска необходимо разработать программы для расчета индивидуальных рисков развития КРР, которые должны быть доступны широкому кругу населения (особенно группам риска).
Заключение
Колоноскопия – основной метод исследования толстого кишечника, который характеризуется высокой эффективностью и возможностью исследования всех отделов толстой кишки. Выявление и удаление эпителиальных образований толстого кишечника «холодными» методами – безопасная и эффективная техника с минимальным риском осложнений (менее 1 %), которую рекомендуется проводить во время скрининговой колоноскопии в амбулаторных условиях при выявлении образований с последующей их гистологической верификацией.

1. Mármol I., Sánchez-de-Diego C., Pradilla Dieste A., Cerrada E. et al. Colorectal carcinoma: a general overview and future perspectives in colorectal cancer. Int J Mol Sci 2017;18(1):197. DOI: 10.3390/ijms18010197
2. Chan P.W., Ngu J.H., Poh Z., Soetikno R. Colorectal cancer screening. Singapore Med J 2017;58(1):24–8. DOI: 10.11622/smedj.2017004
3. Bretthauer M., Løberg M., Wieszczy P. et al. Effect of colonoscopy screening on risks of colorectal cancer and related death. N Engl J Med 2022;387(17):1547–56. DOI: 10.1056/NEJMoa2208375
4. Кашин С.В., Нехайкова Н.В., Завьялов Д.В. и др. Скрининг колоректального рака: общая ситуация в мире и рекомендованные стандарты качества колоноскопии. Доказательная гастроэнтерология 2017;6(4):32–52. DOI: 10.17116/dokgastro20176432-52 Kashin S.V., Nekhaykova N.V., Zav’yalov D.V. et al. The colorectal cancer screening: the current global situation and the main standards for the quality of screening colonoscopy recommended by the European Society of Gastrointestinal Endoscopy (ESGE). Dokazatel’naya gastroenterologiya = Russian Journal of Evidence-Based Gastroenterology 2017;6(4):32–52. (In Russ.). DOI: 10.17116/dokgastro20176432-52
5. Ladabaum U., Dominitz J.A., Kahi C., Schoen R.E. Strategies for colorectal cancer screening. Gastroenterology 2020;158(2):418–32. DOI:10.1053/j.gastro.2019.06.043
2. Chan P.W., Ngu J.H., Poh Z., Soetikno R. Colorectal cancer screening. Singapore Med J 2017;58(1):24–8. DOI: 10.11622/smedj.2017004
6. Hofseth L.J., Hebert J.R., Chanda A. et al. Early-onset colorectal cancer: initial clues and current views. Nat Rev Gastroenterol Hepatol 2020;17(6):352–64. DOI: 10.1038/s41575- 019-0253-4
Эндоскопическая резекция слизистой методом «холодной» петли заключалась в захвате образования петлей диаметром 10–15 мм с небольшим участком визуально неизмененных окружающих тканей. Затем выполняли механическое срезание образования, его извлечение с помощью аспирации через канал эндоскопа и оценивали рану при ее орошении физиологическим раствором через канал эндоскопа. Отсутствие остаточной ткани образования по краю дефекта слизистой оболочки толстой кишки являлось критерием радикальности полипэктомии.
Частота выявления аденом – это отношение числа колоноскопий, в ходе которых выявлена хотя бы одна аденома у пациентов 50 лет и старше, к общему числу колоноскопий у пациентов 50 лет и старше.
Частота выявления полипов – это отношение числа колоноскопий, при которых визуализирован хотя бы один полип у больных старше 50 лет, к общему числу скрининговых колоноскопий у больных 50 лет и старше.
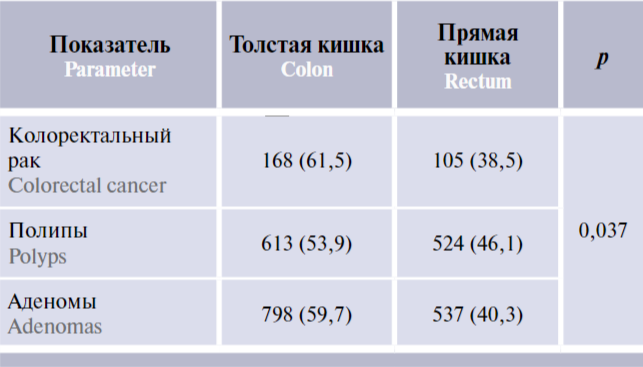
Таблица 1. Число выявленных случаев колоректального рака, полипов и аденом в зависимости от их локализации, n (%)
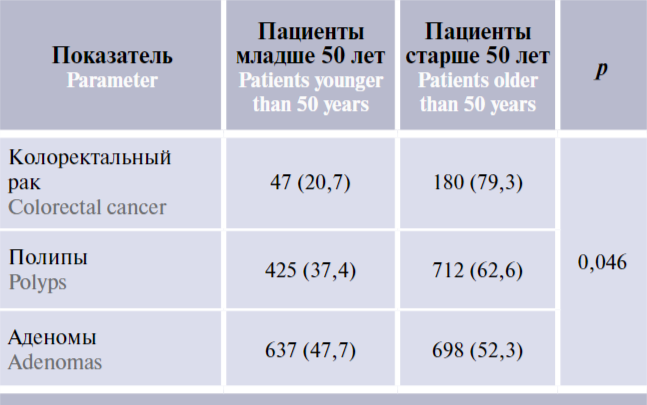
Таблица 2. Число выявленных случаев колоректального рака, полипов и аденом у пациентов в зависимости от возраста, n (%)
7. Baidoun F., Elshiwy K., Elkeraie Y. et al. Colorectal cancer epidemiology: recent trends and impact on outcomes. Current Drug Targets 2021;22(9):998–1009. DOI: 10.2174/1389450121999201117115717
8. Simon K. Colorectal cancer development and advances in screening. Clin Interv Aging 2016;11:967–76. DOI: 10.2147/CIA.S109285
9. Агапов М.Ю., Халин К.Д., Барсуков А.С. и др. Эффективность и безопасность холодной петлевой полипэктомии при полипах толстой кишки размером ≤8 мм. Экспериментальная и клиническая гастроэнтерология 2016;4(128):56–60. Agapov M.Yu., Khalin K.D., Barsukov A.S. et al. Efficacy and safety of cold loop polypectomy for colon polyps ≤8 mm in size. Eksperimental’naya i klinicheskaya gastroenterologiya = Experimental and Clinical Gastroenterology 2016;4(128):56–60. (In Russ.).
9. Агапов М.Ю., Халин К.Д., Барсуков А.С. и др. Эффективность и безопасность холодной петлевой полипэктомии при полипах толстой кишки размером ≤8 мм. Экспериментальная и клиническая гастроэнтерология 2016;4(128):56–60. Agapov M.Yu., Khalin K.D., Barsukov A.S. et al. Efficacy and safety of cold loop polypectomy for colon polyps ≤8 mm in size. Eksperimental’naya i klinicheskaya gastroenterologiya = Experimental and Clinical Gastroenterology 2016;4(128):56–60. (In Russ.).
10. Старостина Р.А., Гатауллин Б.И., Валитов Б.Р. и др. Колоректальный рак: эпидемиология и факторы риска. Поволжский онкологический вестник 2021;4(48):2–12. Starostina R.A., Gataullin B.I., Valitov B.R. et al. Colorectal cancer: epidemiology and risk factors. Povolzhskij onkologicheskij vestnik = Volga Oncological Bulletin 2021;4(48):2–12. (In Russ.).
11. Злокачественные новообразования ободочной кишки и ректосигмоидного отдела. Клинические рекомендации. М., 2020. 50 с. Malignant neoplasms of the colon and rectosigmoid. Clinical guidelines. Moscow, 2020. 50 p. (In Russ).
12. Гиберт Б.К., Матвеев И.А., Махнев А.В. Аудит качества протоколов диагностических колоноскопий в программе скрининга колоректального рака. Колопроктология 2022;3(21):20–6. DOI: 10.33878/2073-7556-2022-21-3-20-26 Gibert B.K., Matveev I.A., Makhnev A.V. Quality audit of diagnostic colonoscopy protocols in the colorectal cancer screening program. Koloproktologiya = Coloproctology 2022;3(21):20–6. (In Russ.). DOI: 10.33878/2073-7556-2022-21-3-20-26
13. Bray C., Bell L.N., Liang H. et al. Colorectal cancer screening. WMJ 2017;116(1):27–33.
14. Десятов Е.Н., Алиев Ф.Ш., Зуев В.Ю. и др. Колоректальный скрининг. Первые результаты. Онкологическая колопроктология 2017;4:31–7. DOI: 10.17650/2220-3478-2017-7-4-31-37 Desyatov E.N., Aliev F.Sh., Zuev V.Yu. et al. Colorectal screening. The first results. Onkologicheskaya koloproktologiya = Oncological coloproctology 2017;4:31–7. (In Russ.). DOI: 10.17650/2220-3478-2017-7-4-31-37
15. Ortigão R., Weigt J., Afifi A., Libânio D. Cold versus hot polypectomy/endoscopic mucosal resection – a review of current evidence. United European Gastroenterol J 2021;9(8):938–46. DOI: 10.1002/ueg2.12130
15. Ortigão R., Weigt J., Afifi A., Libânio D. Cold versus hot polypectomy/endoscopic mucosal resection – a review of current evidence. United European Gastroenterol J 2021;9(8):938–46. DOI: 10.1002/ueg2.12130
15. Ortigão R., Weigt J., Afifi A., Libânio D. Cold versus hot polypectomy/endoscopic mucosal resection – a review of current evidence. United European Gastroenterol J 2021;9(8):938–46. DOI: 10.1002/ueg2.12130
12. Гиберт Б.К., Матвеев И.А., Махнев А.В. Аудит качества протоколов диагностических колоноскопий в программе скрининга колоректального рака. Колопроктология 2022;3(21):20–6. DOI: 10.33878/2073-7556-2022-21-3-20-26 Gibert B.K., Matveev I.A., Makhnev A.V. Quality audit of diagnostic colonoscopy protocols in the colorectal cancer screening program. Koloproktologiya = Coloproctology 2022;3(21):20–6. (In Russ.). DOI: 10.33878/2073-7556-2022-21-3-20-26
13. Bray C., Bell L.N., Liang H. et al. Colorectal cancer screening. WMJ 2017;116(1):27–33.



















