
Введение
По данным Всемирной организации здравоохранения за 2021 год, ежегодно у 400 тысяч детей и подростков в возрасте до 19 лет диагностируют онкологические заболевания. В настоящее время существуют эффективные протоколы лечения, позволяющие сохранить жизнь более чем 80 % пациентов, столкнувшихся с онкологическим диагнозом в детстве [1]. С ростом числа людей, перенесших онкологические заболевания в молодом возрасте, вопрос о сохранении репродуктивной функции приобретает все большее значение. У меньшинства молодых пациентов, которым предстоит противоопухолевое лечение, применяются методы сохранения фертильности: лишь у 45 % мальчиков и 23 % девочек репродуктивная функция после проведенного лечения не пострадала [2].
Как противоопухолевая терапия, так и основное заболевание пациента могут привести к репродуктивной дисфункции и в дальнейшем к бесплодию. Противоопухолевое лечение может иметь как немедленные, так и отсроченные неблагоприятные последствия для репродуктивного здоровья [3]. По данным научных исследований, у взрослых пациентов, перенесших краниальную лучевую терапию и химиотерапию в связи с лечением лейкоза в детском возрасте, выявлены значительные нарушения фертильности и снижение частоты наступления беременности [4, 5]. Сохранение репродуктивной функции у детей и подростков при терапии злокачественных новообразований является одним из ключевых аспектов проводимого лечения, способствующим сохранению как физического, так и психологического здоровья во взрослой жизни.
Влияние основного заболевания и противоопухолевой терапии на репродуктивную функцию
Как предлагаемая противоопухолевая терапия, так и тип злокачественного новообразования, а также общее состояние пациента способны привести к нарушению функции гонад и бесплодию. Опухоли могут оказывать влияние на весь организм, в частности на половую систему; так, например, при неходжкинских лимфомах часто наблюдается поражение яичников [5].
Основными методами лечения в детском возрасте являются химиолучевая терапия и хирургическое вмешательство. Риск гонадотоксичности прямо коррелирует с увеличением кумулятивной дозы химиотерапевтических препаратов и лучевой нагрузки [6]. В контексте лучевой терапии ключевое значение имеют зона облучения, доза облучения и репродуктивный статус пациента. При облучении абдоминальной и/или тазовой области у девочек препубертатного возраста дозой свыше 15 Гр >80 % пациенток подвергаются стерилизации. У девушек, достигших половой зрелости, критическая доза облучения составляет >80 Гр. Общее облучение тела вне зависимости от степени лучевой нагрузки сопряжено с высоким риском развития бесплодия [7].
По данным Американского колледжа акушеров и гинекологов (ACOG), облучение области головы также может привести к дисфункции гипоталамо-гипофизарно-гонадной оси, растормаживанию гипоталамуса и стимуляции секреции кортикотропина, что, в свою очередь, способствует развитию преждевременного полового созревания [8]. По результатам метаанализа W. Gao и соавт., у более 10 тысяч пациенток, прошедших курс лечения с применением облучения, была выявлена достоверная связь между применением радиотерапии и мертворождением, низкой массой тела плода, низким уровнем антимюллерова гормона, развитием острой недостаточности яичников и бесплодия [9].
В отличие от лучевой терапии, химиотерапевтическое лечение всегда обладает системным действием и оказывает токсическое влияние на все органы, в том числе и на гонады. К химиотерапевтическим агентам, повышающим риск развития дисфункции яичников, относятся алкилирующие агенты, неклассические алкиляторы (дакарбазин, темозоломид) и соединения на основе тяжелых металлов [8]. Три наиболее часто используемых препарата – циклофосфамид, цисплатин и доксорубицин – провоцируют развитие преждевременной недостаточности яичников, вызывая гибель и/или ускоренную активацию примордиальных фолликулов и атрезию растущих.
Данные препараты также стимулируют воспаление, что приводит к повреждению кровеносных сосудов и стромального компонента [10]. Эти результаты подчеркивают важность своевременного выполнения криоконсервации тканей яичника. Вследствие временной или перманентной недостаточности яичников у девушек постпубертатного возраста репродуктивная функция нарушается, а у девочек, не достигших полового созревания, оно откладывается или не наступает вовсе [11].
Таким образом, применение противоопухолевой терапии у детей и подростков может иметь необратимые последствия для их репродуктивного здоровья в будущем. В связи с этим перед началом лечения необходима тщательная оценка его потенциальной гонадотоксичности для дальнейшего принятия решения о подборе оптимального метода сохранения фертильности.
Факторы, влияющие на выбор метода сохранения фертильности
Ключевым аспектом для выбора подходящей стратегии поддержания репродуктивной функции является определение полового статуса пациента. В связи с физиологическими и анатомическими изменениями, происходящими во время полового созревания, методы сохранения фертильности у пациентов пре- и постпубертатного возраста различны. Пациентки препубертатного возраста не имеют зрелых гамет, у них отсутствует овуляция, в связи с чем криоконсервация яйцеклеток становится невозможной.
Стимуляция овуляции противопоказана девочкам, не достигшим половой зрелости, поскольку избыточное количество гонадотропных гормонов индуцирует преждевременное половое созревание, приводящее к эндокринной дизрегуляции детского организма, недостаточности яичников, раннему закрытию эпифизарных зон роста костей и повышению риска развития гормонозависимых опухолей, в том числе рака молочной железы [12]. Подробный сбор анамнеза и оценка развития половых признаков по шкале Таннера позволят определить стадию полового созревания пациента, после чего специалистом могут быть предложены методы сохранения фертильности в зависимости от репродуктивного статуса [13].
Методы сохранения фертильности у пациентов препубертатного возраста
Единственным возможным способом сохранения половых клеток у девочек, не достигших полового созревания, является криоконсервация овариальной ткани. Также данный метод может применяться у пациенток постпубертатного возраста, которым рекомендуется срочное начало противоопухолевой терапии.
Согласно клиническим рекомендациям Европейского общества репродукции человека и эмбриологии (ESHRE) 2020 года, только витрификация ооцитов и криоконсервация эмбрионов считаются признанными вариантами сохранения фертильности у взрослых, в то время как криоконсервация ткани яичников все еще относится к инновационным методам [14]. Напротив, в клинических рекомендациях Американского общества репродуктивной медицины (ASRM) 2019 года и Европейского общества медицинской онкологии (ESMO) 2022 года криоконсервация ткани яичника является приемлемым способом сохранения фертильности [15, 16]. Равным образом, по данным Японского общества клинической онкологии (JSCO) 2017 года, криоконсервация ткани яичника у детей должна быть предложена в качестве метода сохранения фертильности, но в рамках клинических испытаний в центрах с опытом его проведения [17].
Метод криоконсервации овариальной ткани заключается в проведении биопсии яичника лапароскопическим путем и замораживании фрагментов коры. Удаление всего яичника является предпочтительным хирургическим методом у молодых пациенток, у которых маленький размер органа не позволяет провести многократную биопсию. В отличие от криоконсервации ооцитов или эмбрионов, преимущество заморозки ткани яичника заключается в восстановлении не только фертильности, но и эндокринных функций [18, 19].
Стоит учесть, что забор ткани яичников проводится не трансвагинально, что исключает определенные психические, физические и религиозные аспекты данной процедуры у подростков, не вступавших в половую связь. Забор ткани – инвазивная процедура, в связи с чем данное вмешательство рекомендуется предлагать лишь после тщательной оценки соотношения пользы и рисков пациентам с высокой вероятностью развития бесплодия (>80 %) [20]. Впоследствии полученная ткань яичника размораживается и трансплантируется хозяину.
Аутологичная трансплантация может быть осуществлена путем пересадки ткани яичника на оставшийся яичник или субперитонеально в полость таза, а также подкожно или внутримышечно в область предплечья или брюшной стенки [21]. В настоящее время более чем 700 женщинам была проведена аутологичная трансплантация яичника. По результатам метаанализа H. Khattak и соавт. c оценкой данных 539 женщин, подвергшихся пересадке замороженного трансплантата, частота наступления беременности, живорождения и выкидышей составила 37, 28 и 37 % соответственно [18]. После ретрансплантации криоконсервированной ткани сообщалось о восстановлении активности яичников в более чем 95 % случаев [22]. В отношении применения криоконсервации ткани яичника и аутологичной трансплантации у детей в научной литературе было зарегистрировано лишь 2 случая рождения живых детей после реимплантации тканей, взятых до менархе [23, 24].
Таким образом, вопреки признанию метода криоконсервации овариальной ткани авторитетными врачебными сообществами в педиатрической практике он все еще считается экспериментальным. Также при трансплантации ткани яичника высок риск контаминации биоптата опухолевыми клетками [25]. Особое внимание стоит уделить обязательному выполнению гистологического и иммуногистохимического исследования образцов тканей на предмет наличия опухолевых клеток [26]. Согласно клиническим рекомендациям ESHRE 2020 г., отсрочка криоконсервации ткани яичников после нескольких циклов химиотерапии может способствовать уменьшению количества злокачественных клеток, однако в данном случае не исключается токсическое повреждение овариальной ткани химиотерапевтическими препаратами [27].
Для снижения риска рецидива опухолей после трансплантации возможно применение технологии созревания ооцитов in vitro (in vitro maturation, IVM), при которой примордиальные фолликулы изолируют из ткани яичника и выращивают in vitro до получения зрелых яйцеклеток [14]. В дальнейшем зрелые яйцеклетки подвергают процедуре экстракорпорального оплодотворения. Также изолированные фолликулы могут быть помещены внутрь альгинатного или фибринового каркаса (модель искусственного яичника), который трансплантируется хозяину [8]. Тем не менее низкая эффективность созревания ооцитов и признаки наличия морфологических аномалий в созревших клетках до сих пор остаются основными нерешенными проблемами данного метода [28]. Технология IVM является экспериментальной и в настоящее время не относится к признанным методам сохранения фертильности ни у взрослых, ни у детей.
Другой потенциальной возможностью сохранения фертильности у девочек является получение ооцитов из стволовых клеток, однако применение данного метода в клинической практике все еще остается под вопросом [29]. Явным ограничением всех экспериментальных исследований с использованием тканей яичников детей является низкая доступность таких образцов для исследования. Проведение качественного статистического анализа для развития экспериментальных методов и внедрения их в клиническую практику требует тесного международного сотрудничества и создания когорты достаточного размера.
Методы сохранения фертильности у пациентов постпубертатного возраста
В связи с окончанием процесса созревания половых клеток многие методы сохранения фертильности, применяющиеся у взрослых, могут использоваться и у подростков, завершивших половое созревание.
Стандартным методом сохранения фертильности у девушек после полового созревания является криоконсервация ооцитов. Данная методика требует предварительной стимуляции яичников с помощью многократных инъекций антагонистов гонадотропин-рилизинг-гормона [30]. Контролируемая стимуляция является наиболее эффективной стратегией получения зрелых яйцеклеток.
Благодаря достижениям репродуктивной медицины в настоящее время возможно осуществить стимуляцию яичников и извлечение яйцеклеток в течение 2 недель, что позволяет не откладывать начало противоопухолевой терапии надолго [31]. Так, гормональную стимуляцию следует начинать на 2-й или 3-й день менструального цикла и продолжать в течение 12 дней. По истечении этого времени проводят трансвагинальное извлечение ооцитов, как правило под седацией или анестезией [6].
Стимуляция овуляции не является лучшим выбором для гормонозависимых видов рака, таких как чувствительные к эстрогену заболевания молочной железы и гинекологические злокачественные новообразования, поскольку избыточное количество половых гормонов увеличивает риск рецидива. В руководстве по клинической практике Американского общества клинической онкологии (ASCO) говорится, что протоколы стимуляции на основе ингибиторов ароматазы в настоящее время хорошо себя зарекомендовали и не увеличивают риск рецидива заболевания в результате стимуляции яичников и последующей беременности [32].
Наиболее часто используемыми методами криоконсервации яйцеклеток являются витрификация и медленное замораживание. До внедрения методики витрификации традиционно использовались контролируемые методы медленного замораживания, успешность которых продемонстрировали многочисленные исследования [33]. В настоящее время существуют работы, доказывающие, что эффективность витрификации выше по сравнению с технологией медленного замораживания. При витрификации выше частота оплодотворения, имплантации, клинической беременности и живорождения [34].
По рекомендациям ASRM и Общества вспомогательных репродуктивных технологий, выживаемость яйцеклеток после витрификации и оттаивания составляет около 90–97 %, уровень оплодотворения– 71–79 %, скорость имплантации– 17–41 %, а вероятность клинической беременности на размороженную яйцеклетку – 4,5–12 % [35]. Однако, по результатам других научных работ, разницы между витрификацией и медленным замораживанием в показателях выживаемости не было выявлено [36].
Еще одним вариантом сохранения фертильности у пациентов в постпубертатном периоде является подавление функции яичников с помощью терапии агонистами гонадотропин-рилизинг-гормона (аГнРГ) [37]. Механизмы влияния аГнРГ на снижение овариальной токсичности при химиотерапии все еще изучаются. Одним из них может являться подавление созревания фолликулов. Химиотерапевтические препараты поражают ткани с быстрым клеточным делением, к которым относится и ткань яичников [38]. Чувствительность созревающих фолликулов к цитотоксическим агентам также подтверждает тот факт, что гонадотокcичность химиотерапии у девочек препубертатного возраста ниже, чем у взрослых [39].
Введение аГнРГ вызывает начальное высвобождение гонадотропина, что вызывает десенсибилизацию рецепторов гонадотропин-рилизинг-гормона. Десенсибилизация, в свою очередь, приводит к гипогонадотропному состоянию, которое удерживает фолликулы в состоянии покоя, делая их менее уязвимыми для химиоиндуцированного повреждения [40]. Также активация рецепторов гонадотропин-рилизинг-гормона на поверхности клеток яичников ингибирует апоптоз и снижает кровоток, в связи с чем концентрация химиотерапевтических препаратов, достигающая яичника, снижается [41, 42]. Таким образом, аГнРГ подавляют функцию яичников, оказывают прямое антиапоптотическое действие и снижают кровоток, что защищает фолликулы от цитотоксического повреждения.
Однако при применении аГнРГ существуют опасения относительно повышения риска кровотечений в связи с увеличением концентрации половых стероидов, что может являться существенным ограничением у детей с панцитопенией [37]. ASCO и ASRM рекомендуют использование аГнРГ при раке молочной железы, а также в случае, когда доказанные методы сохранения фертильности, такие как криоконсервация ооцитов, эмбрионов или тканей яичников, невозможны [32, 43].
Универсальные методы сохранения фертильности
C целью сохранения функциональной ткани яичника при проведении противоопухолевой терапии возможно применение хирургического вмешательства. Так, для нивелирования токсического эффекта лучевой терапии возможно применение лапароскопической репозиции яичников (оофоропексии) у пациентов как препубертатного, так и постпубертатного возраста [17]. Рекомендуется выполнять двустороннюю транспозицию, при которой яичники должны располагаться выше и латеральнее поля лучевой терапии [44]. Перемещение проходит либо к локальным структурам, таким как ямка яичника, контралатеральный яичник и боковая стенка таза, либо к отдаленным областям, таким как подкожные области предплечья и забрюшинное пространство под брюшной стенкой [6].
По окончании лечения яичники возвращаются в исходное положение, что позволяет восстановить репродуктивную функцию [37]. По клиническим рекомендациям ACOG и ASCO, транспозицию яичников следует выполнять пациенткам, которым планируется проведение лучевой терапии на область малого таза [8, 32]. Также оофоропексия может защитить от радиационно-индуцированной недостаточности яичников девочек, получающих облучение позвоночника для лечения опухолей центральной нервной системы [45].
В то же время специалисты должны объяснять пациентам, что процедура не имеет стопроцентной эффективности, поскольку яичники не всегда могут быть полностью защищены из-за рассеяния излучения. Стоит учитывать, что кровоснабжение яичника осуществляется из 2 источников: яичниковой артерии и ветви маточной артерии. При анатомических особенностях васкуляризации яичников и хорошо развитых маточно-яичниковых анастомозах оофоропексия может привести к нарушению кровоснабжения и, как следствие, к яичниковой недостаточности [46].
Таким образом, к основным методам сохранения фертильности у девочек и девушек до 18 лет относятся криоконсервация овариальной ткани или ооцитов, созревание ооцитов in vitro, аутотрансплантация, цитопротекторная фармакотерапия аГнРГ и оофоропексия. Описанные методы суммированы в таблице.
Внедрение методов сохранения фертильности в клиническую практику
Согласно опросам, среди девушек, переживших рак, только 48 % пациенток предоставляли информацию о влиянии лечения на фертильность, а методы сохранения фертильности предлагали лишь 14 % [47]. Основным фактором, препятствующим применению методов в клинической практике, является отсутствие структурированной и скоординированной программы сохранения фертильности [48]. Примеры таких программ в настоящее время уже существуют в мировой практике [49].
Одними из подходов к внедрению методов сохранения фертильности являются введение в обязательную практику выполнения оценки потенциальных рисков лечения и инициирование дискуссий о сохранении фертильности, включая варианты, преимущества, риски и затраты для пациентов [50]. Обсуждение потенциальных рисков проводимого лечения должно начинаться во время постановки диагноза [32]. Особое внимание должно уделяться раннему направлению пациенток к специалистам по репродуктивной медицине. Учитывая трудность принятия решения для пациентов, столкнувшихся с опасным для жизни заболеванием, и их родителей, пациенткам должно быть предоставлено соответствующее время для принятия решения, и раннее направление к соответствующим специалистам является ключевым фактором, обеспечивающим эту возможность [51].
Этическая сторона вопроса
В Российской Федерации, согласно Федеральному закону «Об основах охраны здоровья граждан», подростки имеют право на добровольное информированное согласие на медицинское вмешательство с 15 лет. До этого возраста решения, касающиеся их здоровья, принимают их родители или официальные представители. Когда ребенок получает информацию о риске снижения фертильности, мнение родителя оказывает существенное влияние на его решение. Кроме того, если информация была предоставлена только родителю, существует вероятность утаивания данных о здоровье ребенка от него самого.
Результаты одного из опросов показали, что несовершеннолетние, еще не столкнувшиеся с беременностью, родами или браком, желают иметь детей в будущем. Однако, чем меньше был возраст, тем больше опрошенных не имели никакого мнения по поводу сохранения фертильности [52]. Исследования доказывают, что подростки хотят, чтобы их взгляды учитывались, но немногие взрослые считают необходимым выполнять их желания. Важно отметить, что, учитывая возрастную группу и деликатный характер темы, во время консультации пациентам должна предлагаться возможность свободно говорить без присутствия родителей [50].
Кроме того, учреждения могут разрабатывать образовательные материалы для заинтересованных пациентов и общественности, чтобы облегчить предоставление информации [14]. Предоставление соответствующей медицинской информации должно быть задокументировано в медицинской карте пациента, и пациенты, которые решат обратиться для применения методов сохранения фертильности, должны предоставить письменное информированное согласие [14]. Кроме того, следует учитывать технические и этические проблемы при предложении пациентам передовых и экспериментальных вариантов сохранения фертильности, которые могут применяться только в условиях клинических испытаний.
Заключение
В настоящее время в проблеме сохранения фертильности у онкологических больных в детском возрасте остается множество нерешенных вопросов. Возможными методами сохранения половой функции для детей препубертатного периода являются криоконсервирование овариальной ткани или ооцитов и дальнейшая аутотрансплантация, в том числе ооцитов, созревших в искусственных условиях c применением технологии IVM и/или модели искусственных гонад.
Методы считаются экспериментальными и могут проводиться только в условиях клинических испытаний. После достижения полового созревания возможно применение криоконсервации ооцитов, перед забором которых проводится процедура стимуляции яичников с помощью аГнРГ. Вопрос применения препаратов аГнРГ одновременно с химиотерапией носит дискуссионный характер. Как для препубертатного, так и для постпубертатного периода при облучении области таза имеет смысл проведение оофоропексии.
Выбор метода сохранения репродуктивной функции зависит от множества факторов: общего состояния ребенка, типа злокачественного заболевания, возраста и полового статуса пациента, возможности медицинского учреждения, а также юридических и финансовых аспектов. Ключевым фактором усовершенствования способов сохранения фертильности и внедрения их в клиническую практику является необходимость проведения дальнейших клинических исследований с участием детей и подростков. Кроме того, необходимо урегулирование юридических и законодательных вопросов для успешного введения способов сохранения репродуктивного потенциала в педиатрическую практику.
- Введение
- Влияние основного заболевания и противоопухолевой терапии на репродуктивную функцию
- Факторы, влияющие на выбор метода сохранения фертильности
- Методы сохранения фертильности у пациентов препубертатного возраста
- Методы сохранения фертильности у пациентов постпубертатного возраста
- Универсальные методы сохранения фертильности
- Внедрение методов сохранения фертильности в клиническую практику
- Этическая сторона вопроса
- Заключение

1. Lam C.G., Howard S.C., Bouffet E., Pritchard-Jones K. Science and health for all children with cancer. Science 2019;363(6432):1182–6. DOI: 10.1126/science.aaw4892
2. El Alaoui-Lasmaili K., Nguyen-Thi P.L., Demogeot N. et al. Fertility discussions and concerns in childhood cancer survivors, a systematic review for updated practice. Cancer Med 2022. DOI: 10.1002/cam4.5339
3. Rossi G., Kicinski M., Suciu S. et al. Fertility status among longterm childhood acute lymphoblastic leukaemia survivors enrolled between 1971 and 1998 in EORTC CLG studies: results of the 58 Late Adverse Effects study. Hum Reprod 2022;37(1). DOI: 10.1093/humrep/deab236
4. Gerstl B., Sullivan E., Koch J. et al. Reproductive outcomes following a stem cell transplant for a haematological malignancy in female cancer survivors: a systematic review and meta-analysis. Support Care Cancer 2019;27(12). DOI: 10.1007/s00520-019-05020-8
5. McCarten K.M., Nadel H.R., Shulkin B.L., Cho S.Y. Imaging for diagnosis, staging and response assessment of Hodgkin lymphoma and non-Hodgkin lymphoma. Pediatr Radiol 2019;49(11). DOI: 10.1007/s00247-019-04529-8
5. McCarten K.M., Nadel H.R., Shulkin B.L., Cho S.Y. Imaging for diagnosis, staging and response assessment of Hodgkin lymphoma and non-Hodgkin lymphoma. Pediatr Radiol 2019;49(11). DOI: 10.1007/s00247-019-04529-8
6. Burns K.C., Hoefgen H., Strine A., Dasgupta R. Fertility preservation options in pediatric and adolescent patients with cancer. Cancer 2018;124(9). DOI: 10.1002/cncr.31255
7. Marci R., Mallozzi M., Di Benedetto L. et al. Radiations and female fertility. Reprod Biol Endocrinol 2018;16(1):112. DOI: 10.1186/s12958-018-0432-0
8. ACOG Committee Opinion No. 747: Gynecologic Issues in Children and Adolescent Cancer Patients and Survivors. Obstet Gynecol 2018;132(2). DOI: 10.1097/AOG.0000000000002763
9. Gao W., Liang J.X., Yan Q. Exposure to radiation therapy is associated with female reproductive health among childhood cancer survivors: a meta-analysis study. J Assist Reprod Genet 2015;32(8). DOI: 10.1007/s10815-015-0490-6
8. ACOG Committee Opinion No. 747: Gynecologic Issues in Children and Adolescent Cancer Patients and Survivors. Obstet Gynecol 2018;132(2). DOI: 10.1097/AOG.0000000000002763
10. Spears N., Lopes F., Stefansdottir A. et al. Ovarian damage from chemotherapy and current approaches to its protection. Hum Reprod Update 2019;25(6). DOI: 10.1093/humupd/dmz027
11. Haavisto A., Wettergren L., Lampic C., Lähteenmäki P.M.J.K. Premature ovarian insufficiency and chance of pregnancy after childhood cancer: A population-based study (the Fex-Can study). Int J Cancer 2023;153(3):644–53. DOI: DOI: 10.1002/ijc.34541.
12. Cheng T.S., Ong K.K., Biro F.M. Adverse effects of early puberty timing in girls and potential solutions. J Pediatr Adolesc Gynecol 2022;35(5). DOI: 10.1016/j.jpag.2022.05.005
13. Halpern J.A., Das A., Faw C.A., Brannigan R.E. Oncofertility in adult and pediatric populations: Options and barriers. Transl Androl Urol 2020;9. DOI: 10.21037/tau.2019.09.27
14. ESHRE Guideline Group on Female Fertility Preservation, Anderson R.A., Amantet F. et al. ESHRE guideline: female fertility preservation. Hum Reprod Open 2020;2020(4):hoaa052. DOI: 10.1093/hropen/hoaa052
15. Practice Committee ofthe American Society for Reproductive Medicine. Fertility preservation in patients undergoing gonadotoxic therapy or gonadectomy: a committee opinion. Fertil Steril 2019;112:1022–33.
16. Mountzios G., Bielack S.S. ESMO Handbook of Cancer in Adolescents and Young Adults. 2022.
17. Tozawa A., Kimura F., Takai Y. et al. Japan Society of Clinical Oncology Clinical Practice Guidelines 2017 for fertility preservation in childhood, adolescent, and young adult cancer patients: part 2. Int J Clin Oncol 2022;27(2). DOI: 10.1007/s10147-021-02076-7
18. Khattak H., Malhas R., Craciunas L. et al. Fresh and cryopreserved ovarian tissue transplantation for preserving reproductive and endocrine function: A systematic review and individual patient data meta-analysis. Hum Reprod Update 2022;28(3). DOI: 10.1093/humupd/dmac003
19. Kim S.S. Assessment of long term endocrine function after transplantation of frozen-thawed human ovarian tissue to the heterotopic site: 10 year longitudinal follow-up study. J Assist Reprod Genet 2012;29(6). DOI: 10.1007/s10815-012-9757-3
20. Wallace W.H.B., Anderson R.A., Irvine D.S. Fertility preservation for young patients with cancer: Who is at risk and what can be offered? Lancet Oncol 2005;6(4). DOI: 10.1016/S1470-2045(05)70092-9
21. Bystrova O., Lapina E., Kalugina A. et al. Heterotopic transplantation of cryopreserved ovarian tissue in cancer patients: a case series. Gynecol Endocrinol 2019;35(12):1043–9. DOI: 10.1080/09513590.2019.1648413
18. Khattak H., Malhas R., Craciunas L. et al. Fresh and cryopreserved ovarian tissue transplantation for preserving reproductive and endocrine function: A systematic review and individual patient data meta-analysis. Hum Reprod Update 2022;28(3). DOI: 10.1093/humupd/dmac003
22. Donnez J., Dolmans M.M., Diaz C., Pellicer A. Ovarian cortex transplantation: Time to move on from experimental studies to open clinical application. Fertil Steril 2015;104(5). DOI: 10.1016/j.fertnstert.2015.08.005
23. Demeestere I., Simon P., Dedeken L. et al. Live birth after autograft of ovarian tissue cryopreserved during childhood. Hum Reprod 2015;30(9):2107–9. DOI: 10.1093/humrep/dev128
24. Matthews S.J., Picton H., Ernst E., Andersen C.Y. Successful pregnancy in a woman previously suffering from β-thalassemia following transplantation of ovarian tissue cryopreserved before puberty. Minerva Ginecol 2018;70(4). DOI: 10.23736/S0026-4784.18.04240-5
25. Kourta D., Kanbar M., Amorim C.A. Cancer cell contamination and decontamination methods for ovaries and testes: special focus on prepubertal gonads with a view to safe fertility restoration. Hum Reprod 2023;38(5):780–98. DOI: 10.1093/humrep/dead054
26. Cariati F., Carbone L., Iorio G.G. et al. Cryopreservation of ovarian tissue: the biggest challenge of oncofertility. Minerva Obstet Gynecol 2022. DOI: 10.23736/s2724-606x.22.05066-7
27. Lambertini M., Peccatori F.A., Demeestere I. et al. Fertility preservation and post-treatment pregnancies in post-pubertal cancer patients: ESMO Clinical Practice Guidelines. Ann Oncol 2020;31(12). DOI: 10.1016/j.annonc.2020.09.006
14. ESHRE Guideline Group on Female Fertility Preservation, Anderson R.A., Amantet F. et al. ESHRE guideline: female fertility preservation. Hum Reprod Open 2020;2020(4):hoaa052. DOI: 10.1093/hropen/hoaa052
8. ACOG Committee Opinion No. 747: Gynecologic Issues in Children and Adolescent Cancer Patients and Survivors. Obstet Gynecol 2018;132(2). DOI: 10.1097/AOG.0000000000002763
28. McLaughlin M., Albertini D.F., Wallace W.H.B. et al. Metaphase II oocytes from human unilaminar follicles grown in a multistep culture system. Mol Hum Reprod 2018;24(3). DOI: 10.1093/molehr/gay002
29. Wagner M., Yoshihara M., Douagi I. et al. Single-cell analysis of human ovarian cortex identifies distinct cell populations but no oogonial stem cells. Nat Commun 2020;11(1):1147. DOI: 10.1038/s41467-020-14936-3
30. Porcu E., Cipriani L., Dirodi M. et al. Successful pregnancies, births, and child development following oocyte cryostorage in female cancer patients during 25 years of fertility preservation. Cancers (Basel) 2022;14(6). DOI: 10.3390/cancers14061429
31. Teresa A., Santos A.S.G. Recomendações clínicas para a preservação da fertilidade no doente oncológico. Available at: https://www.spmr.pt/attachments/recom-spmr.pdf.
6. Burns K.C., Hoefgen H., Strine A., Dasgupta R. Fertility preservation options in pediatric and adolescent patients with cancer. Cancer 2018;124(9). DOI: 10.1002/cncr.31255
32. Oktay K., Harvey B.E., Loren A.W. Fertility preservation in patients with cancer: ASCO clinical practice guideline update summary. J Oncol Pract 2018;14(6). DOI: 10.1200/JOP.18.00160
33. Abdelhafez F.F., Desai N., Abou-Setta A.M. et al. Slow freezing, vitrification and ultra-rapid freezing of human embryos: A systematic review and meta-analysis. Reprod Biomed Online 2010;20(2):209–22. DOI: 10.1016/j.rbmo.2009.11.013
34. Glujovsky D., Riestra B., Sueldo C. et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. Cochrane Database Syst Rev 2014:(9):CD010047. DOI: 10.1002/14651858.CD010047.pub2
35. Practice Committees of the American Society for Reproductive Medicine and the Society for Assisted Reproductive Technology. Mature oocyte cryopreservation: A guideline. Fertil Steril 2013;99(1):37–43. DOI: 10.1016/j.fertnstert.2012.09.028
36. Youm H.S., Choi J.R., Oh D., Rho Y.H. Vitrfication and slow freezing for cryopreservation of germinal vesicle-stage human oocytes: A Bayesian meta-analysis. Cryo-Letters 2017;38(6):455–62.
37. Appiah L.C., Fei Y.F., Olsen M. et al. Disparities in female pediatric, adolescent and young adult oncofertility: A needs assessment. Cancers (Basel) 2021;13(21). DOI: 10.3390/cancers13215419
38. Valsamakis G., Valtetsiotis K., Charmandari E. et al. GnRH analogues as a co-treatment to therapy in women of reproductive age with cancer and fertility preservation. Int J Mol Sci 2022;23(4):2287. DOI: 10.3390/ijms23042287
39. Fidler M.M., Reulen R.C., Winter D.L. et al. Long term cause specific mortality among 34489 five year survivors of childhood cancer in Great Britain: population based cohort study. BMJ 2016;354:i4351. DOI: 10.1136/bmj.i4351
40. Chapman R.M., Sutcliffe S.B. Protection of ovarian function by oral contraceptives in women receiving chemotherapy for Hodgkin’s disease. Blood 1981;58(4). DOI: 10.1182/blood.v58.4.849.bloodjournal584849
41. Whitelaw P.F., Eidne K.A., Sellar R. et al. Gonadotropin-releasing hormone receptor messenger ribonucleic acid expression in rat ovary. Endocrinology 1995;136(1):172–9. DOI: 10.1210/endo.136.1.7828528
42. Reinsch R.C., Murphy A.A., Morales A.J., Yen S.S.C. The effects of RU 486 and leuprolide acetate on uterine artery blood flow in the fibroid uterus: A prospective, randomized study. Am J Obstet Gynecol 1994;170(6). DOI: 10.1016/S0002-9378(94)70332-9
37. Appiah L.C., Fei Y.F., Olsen M. et al. Disparities in female pediatric, adolescent and young adult oncofertility: A needs assessment. Cancers (Basel) 2021;13(21). DOI: 10.3390/cancers13215419
32. Oktay K., Harvey B.E., Loren A.W. Fertility preservation in patients with cancer: ASCO clinical practice guideline update summary. J Oncol Pract 2018;14(6). DOI: 10.1200/JOP.18.00160
43. Ethics Committee of the American Society for Reproductive Medicine. Fertility preservation and reproduction in patients facing gonadotoxic therapies: An Ethics Committee opinion. Fertil Steril 2018;110(3):380–6. DOI: 10.1016/j.fertnstert.2018.05.034 44. Donovan E.K., Covens A.L., Kupets R.S., Leung E.W. The role of oophoropexy in patients with gynecological cancer who need radiation therapy. Int J Gynecol Cancer 2022;32(3). DOI: 10.1136/ijgc-2021-002471
17. Tozawa A., Kimura F., Takai Y. et al. Japan Society of Clinical Oncology Clinical Practice Guidelines 2017 for fertility preservation in childhood, adolescent, and young adult cancer patients: part 2. Int J Clin Oncol 2022;27(2). DOI: 10.1007/s10147-021-02076-7
44. Donovan E.K., Covens A.L., Kupets R.S., Leung E.W. The role of oophoropexy in patients with gynecological cancer who need radiation therapy. Int J Gynecol Cancer 2022;32(3). DOI: 10.1136/ijgc-2021-002471
6. Burns K.C., Hoefgen H., Strine A., Dasgupta R. Fertility preservation options in pediatric and adolescent patients with cancer. Cancer 2018;124(9). DOI: 10.1002/cncr.31255
37. Appiah L.C., Fei Y.F., Olsen M. et al. Disparities in female pediatric, adolescent and young adult oncofertility: A needs assessment. Cancers (Basel) 2021;13(21). DOI: 10.3390/cancers13215419
8. ACOG Committee Opinion No. 747: Gynecologic Issues in Children and Adolescent Cancer Patients and Survivors. Obstet Gynecol 2018;132(2). DOI: 10.1097/AOG.0000000000002763
32. Oktay K., Harvey B.E., Loren A.W. Fertility preservation in patients with cancer: ASCO clinical practice guideline update summary. J Oncol Pract 2018;14(6). DOI: 10.1200/JOP.18.00160
45. Kuohung W., Ram K., Cheng D.M. et al. Laparoscopic oophoropexy prior to radiation for pediatric brain tumor and subsequent ovarian function. Hum Reprod 2008;23(1):117–21. DOI: 10.1093/humrep/dem368
46. Sheikh G.T., Najafi A., Cunier M. et al. Angiographic detection of utero-ovarian anastomosis and influence on ovarian function after uterine artery embolization. Cardiovasc Intervent Radiol 2020;43(2):231–7. DOI: 10.1007/s00270-019-02305-7
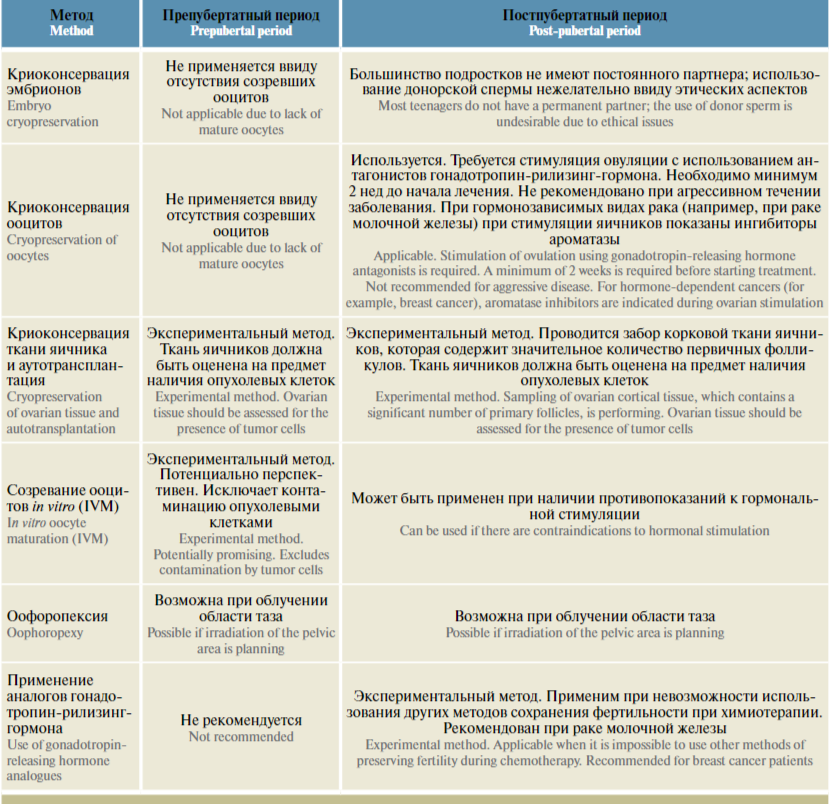
Методы сохранения фертильности у онкологических больных детского возраста в зависимости от полового статуса
47. Armuand G.M., Rodriguez-Wallberg K.A., Wettergren L. et al. Sex differences in fertility-related information received by young adult cancer survivors. J Clin Oncol 2012;30(17):2147–53. DOI: 10.1200/JCO.2011.40.6470
48. Covelli A., Facey M., Kennedy E. et al. Clinicians’ perspectives on barriers to discussing infertility and fertility preservation with young women with cancer. JAMA Netw Open 2019;2(11):e1914511. DOI: 10.1001/jamanetworkopen.2019.14511
49. Van der Perk M.E., van der Kooi A.-L.L.F., van de Wetering M.D. et al. Oncofertility care for newly diagnosed girls with cancer in a national pediatric oncology setting, the first full year experience from the Princess Máxima Center, the PEARL study. PLoS One 2021;16(3):e0246344. DOI: 10.1371/journal.pone.0246344
50. Johnson R.H., Kroon L. Optimizing fertility preservation practices for adolescent and young adult cancer patients. JNCCN J Natl Compr Cancer Netw 2013;11(1). DOI: 10.6004/jnccn.2013.0010
32. Oktay K., Harvey B.E., Loren A.W. Fertility preservation in patients with cancer: ASCO clinical practice guideline update summary. J Oncol Pract 2018;14(6). DOI: 10.1200/JOP.18.00160
51. Jayeon Kim J.E.M. Early referral makes the decision-making about fertility preservation easier: a pilot survey study of young female cancer survivors. Support Care Cancer 2015;23(6):1663–7. DOI: 10.1007/s00520-014-2526-3
52. Takae S., Iwahata Y., Sugishita Y. et al. Survey of understanding and awareness of fertility preservation in pediatric patients: Is conversation about fertility preservation unpleasant for pediatric patients? Front Endocrinol (Lausanne) 2023;13:1074603. DOI: 10.3389/fendo.2022.1074603
50. Johnson R.H., Kroon L. Optimizing fertility preservation practices for adolescent and young adult cancer patients. JNCCN J Natl Compr Cancer Netw 2013;11(1). DOI: 10.6004/jnccn.2013.0010
14. ESHRE Guideline Group on Female Fertility Preservation, Anderson R.A., Amantet F. et al. ESHRE guideline: female fertility preservation. Hum Reprod Open 2020;2020(4):hoaa052. DOI: 10.1093/hropen/hoaa052
14. ESHRE Guideline Group on Female Fertility Preservation, Anderson R.A., Amantet F. et al. ESHRE guideline: female fertility preservation. Hum Reprod Open 2020;2020(4):hoaa052. DOI: 10.1093/hropen/hoaa052



















