
Недавно было показано, что MSI присутствует в большинстве типов рака с различной частотой, при этом наиболее часто встречаясь при колоректальном раке. MSI положительно коррелирует с исходом выживания и предсказывает ответ на иммунотерапию ингибиторами контрольных точек. Именно поэтому так важно правильно выбрать методику определения MSI.
Введение
Микросателлиты – это короткие тандемные, или простые повторяющиеся, последовательности ДНК, состоящие из 1–6 пар оснований. Из всех последовательностей чаще всего наблюдаются повторы GT/CA, которые могут повторяться до 1000 раз [1, 2]. С помощью компьютерных вычислений во всем человеческом геноме было выявлено суммарно более 19 млн микросателлитов. Располагаются они преимущественно в некодирующих областях, интронах, и только около 1% – в кодирующей области генома. В общей сложности частота мутаций в микросателлитных локусах на 1 поколение составляет примерно 10−4, что на несколько порядков выше частоты возникновения мутаций во всем человеческом геноме в целом [1, 3, 4].
Система репарации неспаренных оснований
При возникновении мутаций в цепи ДНК запускается механизм репарации, т. е. процесс исправления допущенной ошибки. За это отвечает система репарации неспаренных оснований ДНК (mismatch repair system, MMR). MMR-система включает в себя 7 генов: MLH1, MLH3, MSH2, MSH3, MSH6, PMS1 и PMS2. Система ответственна за распознавание и удаление неправильно спаренных оснований (не подходящих друг другу согласно принципу комплементарности), образованных в результате ошибок в процессе репликации ДНК (в процессе синтеза дочерней цепи) [5]. Таким образом она предотвращает постоянное воспроизведение мутаций в делящихся клетках. Система MMR является высококонсервативным биологическим процессом, который играет первостепенную роль в сохранении стабильности генома [6].
Во время синтеза дочерней цепи ДНК-полимераза может встраивать некомплементарные нуклеотиды, в результате возникает несоответствие нуклеотидов друг другу на соседних цепях ДНК, из-за чего происходит так называемое проскальзывание ДНК-полимеразы. Сразу после этого происходит запуск процесса репарации. Сначала происходит распознавание белками неправильно спаренных оснований, затем – формирование белкового комплекса, который удаляет измененный участок ДНК и восстанавливает правильную нуклеотидную последовательность ДНК [7]. Если возникают нарушения в системе MMR, полноценный рабочий белковый комплекс не формируется. В результате неполноценный белковый комплекс не исправляет и не удаляет имеющуюся ошибку, и происходит так называемый сдвиг рамки считывания. Как известно, рамка считывания – это последовательность нуклеотидов, определяющая положение первого кодона, с которого начинается считывание белка. Если в результате дисфункции белков системы MMR возникает сдвиг рамки считывания, изменяется вся программа синтеза полипептидной цепи, что влечет за собой раннее появление стоп-кодона, кодирующего прекращение синтеза полипептидной цепи, что, в свою очередь, приводит к инактивации гена, а значит, и к образованию нефункциональных белков [8, 9]. Как следствие, возникает состояние генетической гипермутабельности, или микросателлитная нестабильность (microsatellite instability, MSI). Таким образом, MSI является результатом неспособности белков MMR исправить ошибку репликации ДНК. Возникает дефицит системы репарации неспаренных оснований (dMMR, mismatch repair system deficinity). Количество появляющихся при этом нарушений увеличивается гораздо с большей скоростью, чем в нормальном состоянии, при этом нарушения варьируют по длине фрагмента, а не по последовательности.
Гиперметилирование промотора является важным механизмом подавления транскрипции генов при раке. Известно, что при спорадическом колоректальном раке наиболее частой причиной dMMR является биаллельная инактивация MLH1 посредством гиперметилирования промотора гена MLH1. Метилирующий фенотип CpG-островков (CIMP) характеризуется распространенным метилированием CpG-островков в промоторных областях, вызывая транскрипционный сайленсинг опухолевых супрессоров и генов репарации ДНК [10, 11, 12].
Мутации, возникающие в результате MSI, могут влиять на онкогенез
Микросателлитные мутации, возникающие в кодирующих областях, интронах или нетранслируемых областях генов, могут оказывать положительное или отрицательное влияние на экспрессию генов или функцию белков, вызывая изменения транскрипции или сплайсинга генов. Например, могут быть инактивированы гены – супрессоры опухолей либо может произойти активация или сверхэкспрессия онкогенов. Наглядным примером служит механизм возникновения колоректального рака. В результате мутаций в системе MMR или гиперметилирования промотора гена MLH1 возникает нарушение механизма MMR, что приводит к MSI. Возникает все больше и больше мутаций, в том числе и в микросателлитах, которые расположены в областях кодирования генов, например в гене BRAF. А мутация гена BRAF V600E играет значительную роль в возникновении спорадических форм рака толстой кишки [10].
История открытия MSI
Микросателлитная нестабильность была открыта в 1970–1980 годах. Первым заболеванием человека, связанным с MSI, была пигментная ксеродерма. В 1993 году MSI была впервые описана при колоректальном раке [13, 14, 15].
Явление MSI достаточно часто наблюдается в различных новообразованиях человека, а значит, может служить одной из характеристик опухоли. Однако сообщаемая частота опухолей с MSI при каждой злокачественной нозологии в литературе значительно различалась. Чтобы разобраться с этой путаницей, в 1998 году Национальный институт рака США (National Cancer Institute, NCI) провел семинар, посвященный MSI. В результате была рекомендована единая панель маркеров, так называемая панель Bethesda, состоящая из 5 маркеров: 2 мононуклеотидных маркеров – BAT25 и BAT26, а также 3 динуклеотидных повторов – D2S123, D5S346 и D17S250. Позднее панель Bethesda была объявлена «золотым стандартом» в определении MSI.
MSI-положительный фенотип было рекомендовано разделить на 2 категории: высокий уровень MSI (MSI-H; когда обнаружены нарушения по 2 и более маркерам) и низкий уровень (MSI-L; когда обнаружены нарушения по 1 маркеру) [16].
В 2002 году панель Bethesda была пересмотрена и снова рекомендована в новых руководствах по лечению синдрома Линча, и на сегодняшний день ее используют в некоторых лабораториях. Тем не менее в отношении этой панели возникли некоторые нарекания, которые связаны с наличием в панели динуклеотидных маркеров. Эти маркеры, во-первых, имеют более низкую способность обнаруживать опухоли MSI-H из-за своей более низкой чувствительности по сравнению с мононуклеотидами. Во-вторых, при работе с ними необходимо использовать нормальную ткань для сравнения, поскольку у каждого человека динуклеотиды полиморфны, что приводит к ошибочной классификации опухолей MSS/MSI-L как опухолей MSI-H. В то время как мононуклеотидные маркеры являются наиболее подходящими для обнаружения MSI, поскольку они более чувствительны и почти мономорфны, поэтому не требуют в каждом случае образцов нормальной ткани, сравнение происходит с усредненным контролем [17].
Впоследствии мононуклеотидная панель была запатентована и коммерчески доступна как тест Promega©. Другие тестовые наборы, которые появились на рынке, также в своей основе имеют мононуклеотидные повторы (см. таблицу).
В клинических испытаниях для оценки MSI до сих пор используют как моно-, так и динуклеотидную панели. Например, панель с динуклеотидами применяется в исследованиях фазы II NCT03435107 и NCT03150706, тогда как панель с 5 мононуклеотидами использовалась в опубликованных исследованиях KEYNOTE-016 и KEYNOTE-059.
Важной поправкой к первой панели, внесенной в 2002 году, является то, что, если образец классифицируется как MSI-L только по динуклеотидным маркерам, для окончательной характеристики опухоли рекомендуется дополнительная панель микросателлитных маркеров: BAT40, D10S197, D18S58, D18S69, Mycl1 [17].
Точность анализа MSI на основе ПЦР
В настоящее время, после 30-летнего опыта использования в качестве маркера опухоли, MSI стала одним из лучших параметров для идентификации пациентов, чувствительных к иммунотерапии ингибиторами контрольных точек (immune checkpoint inhibitors, ICIs) [18, 19]. Однако при этом возникает несколько вопросов: какой метод для выявления наиболее чувствительных пациентов лучше и следует ли включать в лечебный протокол опухоли, которые проявляют нестабильность не по мононуклеотидным повторам.
Чтобы ответить на эти вопросы, необходимо рассмотреть механизм dMMR и его связь с проскальзыванием ДНК-полимеразы в различных микросателлитах. В целом существует 2 основных пути распознавания неспаренных оснований:
- MSH2 образует димеры с MSH6 (MutSα), если необходимо устранить несоответствия отдельных нуклеотидов или петель с 1–2 нуклеотидами (в моно- и динуклеотидных повторах);
- в случае, когда неспаренные основания содержат 2 или более нуклеотида (в ди-, три- и тетрануклеотидах), MSH2 связывается с MSH3. Последний включает в себя три- и тетрануклеотидные повторы, ответственные за высокий уровень микросателлитных нарушений в отдельных тетрануклеотидных повторах (elevated microsatellite alterations at selected tetranucleotide repeats, EMAST) [20, 21]. Вслед за этим первичным распознаванием димеры MLH1 и PMS2 связываются друг с другом, образуя комплекс восстановления несоответствия оснований, который активирует другие ферменты, такие как экзонуклеаза, полимераза β и лигаза.
Таким образом, нестабильность возникает в различных типах микросателлитов в зависимости от того, какой ген MMR-системы нарушен. Например, если дефектен только MSH6, повреждаются в основном мононуклеотидные повторы, что проявляется лишь в виде незначительных сдвигов, регистрируемых во время полимеразной цепной реакции (ПЦР).
Это привело к разработке улучшенных мононуклеотидных тестов [22], превосходящих по своей чувствительности панель Bethesda [23, 24]. С другой стороны, в случае дефекта MSH3 нестабильность обнаруживается только в ди-, три- и тетрануклеотидных повторах, но не в мононуклеотидных, и только с помощью ПЦР, которая включает в себя праймеры к данным микросателлитам. Если свою функцию теряют MSH2, MLH1 или PMS2, проскальзывание ДНК-полимеразы может возникнуть во всех типах микросателлитов.
С учетом этих основных фактов оказывается, что анализ на основе мононуклеотидных повторов способен пропустить особые типы MSI. Это было показано E. Stelloo и соавт. при раке эндометрия, где 20 случаев карциномы с потерей экспрессии MLH1/PMS2 или MSH6 были классифицированы как MSS тест-системой Promega [25]. Во всех этих опухолях дальнейший анализ выявил молекулярные признаки MSI, такие как динуклеотидная нестабильность, промоторное метилирование MLH1 и патогенетические варианты MSH6, влияющие на функцию белка.
К сожалению, почти во всех опубликованных до сих пор работах по MSI, в которых использовалась панель Bethesda, она содержала только 1-ю, так называемую референсную, панель праймеров. Однако уже на первом заседании NCI было достигнуто соглашение, что основной задачей 1-й «референсной» панели является отличие MSI-L/MSS опухолей от MSI-H [26]. Но в случае MSI-L, при которой в основном затронуты динуклеотиды, следует использовать дополнительные маркеры, т. e. 2-ю панель праймеров, которая также включает Mycl1, высокочувствительный повтор, идентифицирующий тетрануклеотидную нестабильность, EMAST [20, 27]. Таким образом, многие исследования, в которых использовалась только 1-я панель праймеров, привели к ложным выводам о том, что панель Bethesda не детектирует явление EMAST [20] и определяет MSI как нестабильность только по моно- и динуклеотидам [28]. Поскольку скрининг синдрома Линча был основным направлением в течение последних десятилетий, мононуклеотидные анализы широко использовались при опухолях, ассоциированных с данным синдромом [29, 30]. Однако на сегодняшний день на фоне того, что MSI является высокопрогностическим маркером применения ICIs, использование селективных анализов, исключающих из тестирования большинство повторов MSI, стало сомнительным. M. Baretti и D.T. Le было показано, что примерно в 15% MSI-H опухолей мононуклеотиды не затрагиваются и, следовательно, не обнаруживаются с помощью анализов на основе мононуклеотидов (см. таблицу). При этом независимо от того, какая панель была использована, показатель отсутствия MSI с помощью ПЦР-анализа составляет примерно 10% случаев [23].
Методы определения MSI
Существует несколько методов молекулярно-генетической диагностики MSI, но все их объединяют 2 неизменных этапа: амплификация микросателлитных маркеров с помощью ПЦР и анализ длины фрагмента.
Изменение размера микросателлита определяется в результате сравнения его с размером этого же микросателлита в неизмененной ткани. В качестве неизмененной ткани может выступать любая нормальная ткань, полученная от этого же пациента: нормальная слизистая оболочка, интактный лимфатический узел (без метастаза) или же венозная кровь. Но сейчас потребность в нормальной ткани постепенно уходит в прошлое. Сравнение опухолевого образца происходит с усредненным универсальным контролем, а нормальная ДНК требуется в исключительных случаях.
Первоначально анализ длины фрагмента проводился с помощью электрофореза в полиакриламидном геле. Однако данный метод был довольно трудоемким, длительным и обладал низкой точностью [31].
Со временем ему на смену пришел новый метод, который на сегодняшний день считается «золотым стандартом» в обнаружении MSI. Этот подход сочетает в себе ПЦР с флуоресцентными праймерами и капиллярный электрофорез с использованием секвенатора [32]. Эта методика также была усовершенствована путем постановки мультиплексной ПЦР – когда в одной пробирке смешивают различные праймеры, меченные разными красками. Это дает возможность в одной пробирке проанализировать все 5 исследуемых маркеров за 1 прогон прибора [29].
Еще применяли метод денатурирующей высокоэффективной жидкостной хроматографии (DHPLC), который базируется на разделении цепей ДНК на основе размера и последовательности, а также позволяет получить более чистую картину, чем при капиллярном электрофорезе. Однако при этом существует лимит в обнаружении мутантных аллелей [33, 34].
HRM-метод основан на медленной денатурации ПЦР-продуктов и различии кривых денатурации между опухолевой и нормальной тканями. С помощью этого метода можно обнаружить MSI, но не идентифицировать ее тип [35].
И наконец, применяется секвенирование следующего поколения (NGS), позволяющее определить нестабильность не только в 5 микросателлитах, но и в нескольких тысячах локусов, в зависимости от библиотеки исследуемых генов [36]. Недостатками данного метода являются высокая стоимость и, как следствие, возможность воспроизведения только в крупных медицинских центрах. Кроме того, поскольку технология все еще находится в разработке, она пока не упоминается в клиническом руководстве для врачей (NCCN) [37].
Еще один метод скрининга, сопоставимый по своим параметрам с молекулярно-генетическим тестом на MSI, – иммуногистохимия (ИГХ), с помощью которой исследуются не сами гены MMR-системы, а белки, которые они экспрессируют. В зависимости от уровня экспрессии белков в образце определяется высокий, низкий уровень MSI или же ее отсутствие. Если в образце обнаружена утрата экспрессии генов системы MMR, говорят о MMR-дефиците опухоли.
При сравнении ИГХ и ПЦР следует отметить, что оба эти метода обладают примерно одинаковой специфичностью и чувствительностью при выявлении MSI-H опухолей. Обоим присуща частота ложноотрицательных результатов 5–10% [38]. При этом ИГХ отличают низкая стоимость, простота и легкая воспроизводимость методики, анализ можно провести достаточно быстро, и, самое главное, ИГХ позволяет определить причинно-значимый ген. Однако существенными недостатками методики являются фоновое окрашивание нормальной ткани, которое обусловливает трудности при подсчете, и, самое главное, зависимость результата от специализации и профессионального уровня патологоанатома.
Нельзя приравнивать результат, полученный с помощью ИГХ, к результату, полученному с помощью ПЦР. В итоге, конечно, мы оцениваем MSI образца, но с помощью ИГХ мы оцениваем наличие или отсутствие экспрессии белка системы MMR, в то время как с помощью ПЦР – дисфункцию этой системы, ее неспособность найти и исправить ошибку в последовательности ДНК. Иногда могут возникать расхождения между этими 2 методами, когда экспрессия белков, хотя они уже функционируют некорректно, еще выявляется с помощью ИГХ, поэтому опухоль относят к стабильным, а ПЦР уже обнаруживает MSI, так как оценивает дисфукцию генов MMR, и опухоль является нестабильной. И наоборот, есть работы, показывающие, что ПЦР с использованием мононуклеотидных маркеров может не идентифицировать особые типы MSI [25].
Поскольку с помощью 2 этих методов мы оцениваем разные биологические процессы, для получения наиболее достоверного результата целесообразно использовать оба эти метода в сочетании. В рутинной диагностике сочетанное использование обоих методов имеет смысл только в том случае, когда есть расхождения между полученным результатом теста и клинической картиной.
Заключение
Различные методы, разработанные для выявления MSI при раке, требуют учета 2 основных параметров, которые влияют на эффективность метода. Во-первых, следует с осторожностью выбирать микросателлитные маркеры, чтобы убедиться, что они высокочувствительны и специфичны для обнаружения MSI. Во-вторых, используемый аналитический метод должен быть достаточно чувствительным, чтобы обеспечить четкую идентификацию MSI и генотип мутантного аллеля. Выбранный метод должен иметь низкий предел обнаружения, что делает возможным его применение в образцах с низкой частотой мутантных аллелей.

Системы тестирования MSI на основе ДНК. Маркерная панель, классификаторы MSI и методы обнаружения
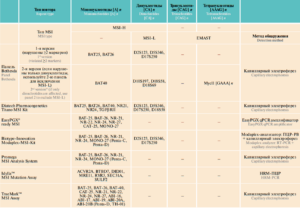
Системы тестирования MSI на основе ДНК. Маркерная панель, классификаторы MSI и методы обнаружения




















