Введение
По данным Международного агентства исследования рака, в 2020 году глобально расчетное число заболевших РМЖ составило 2,2 млн, а стандартизованные по возрасту показатели заболеваемости и смертности составили 57,8 и 13,6 случая на 100 тыс. населения соответственно [1, 2]. В России РМЖ является ведущей онкологической патологией среди лиц обоего пола (12,1%), а также среди женщин (22,1%) на фоне неуклонного роста показателей заболеваемости: в 2021 году стандартизованный показатель составлял 50,4 на 100 тыс. населения. При этом стандартизованный по возрасту показатель смертности от РМЖ за последние 11 лет в России снизился с 16,5 до 12,5 на 100 тыс. населения [3].
Противоположно направленные тренды заболеваемости и смертности отражают рост выживаемости при РМЖ. В глобальной программе прослеживания выживаемости онкологических больных CONCORD-3 установлено, что 5-летняя нетто-выживаемость при РМЖ существенно возрастала в период с 2000 по 2014 год в подавляющем большинстве стран. В последний анализируемый период (2010–2014 годы) она была выше 85% в 25 странах с высоким уровнем дохода и заметно снижалась в странах со сниженным доходом. В России этот показатель составил 71%. Потенциальными причинами различий в выживаемости сравнительно с экономически развитыми странами называют более высокую распространенность РМЖ при первичной диагностике и ограничение доступа к качественному лечению [4].
Эпидемиологический анализ при злокачественных новообразованиях (ЗНО), основанный на данных популяционных регистров рака, включает оценку заболеваемости, а при наличии достоверной и своевременной информации об умерших – и оценку смертности и выживаемости. Расчет популяционных показателей выживаемости при ЗНО – стандартный подход для оценки общей эффективности организации противораковой борьбы на эпидемиологическом уровне [5, 6]. В соответствии с данными эпидемиологических анализов возраст на момент установления диагноза, раса, семейное положение, размер опухоли, стадия T, стадия M, степень злокачественности опухоли и множественность злокачественных опухолей являются независимыми предикторами смерти пациентов с РМЖ [7, 8].
Анализ популяционных факторов прогноза выживаемости при РМЖ позволяет выявить потенциально уязвимые группы больных, на которых могли бы быть направлены целевые организационные меры. Однако в России он представлен небольшим количеством исследований [9, 10], а данные анализов из других стран не могут быть автоматически экстраполированы на российскую популяцию. Популяционный Архангельский областной канцер-регистр (АОКР) осуществляет сплошной учет ЗНО с 2000 года, его качество подтверждено неоднократными международными аудитами, что позволяет использовать его данные для исследований.
Материалы и методы
Характеристика наблюдений. Была выполнена сплошная выборка всех случаев инвазивного (морфологический код МКБО-3 хххх/3) РМЖ из АОКР за 2000–2020 годы. Данные были деперсонализированы, в дальнейшем при необходимости пополнения и модификации рабочей базы данных для сопоставления с базой данных АОКР использовался идентификационный номер пациентов.
Для анализа использовались следующие переменные: возраст (с разбивкой на возрастные подгруппы: до 40, 40–49, 50–59, 60–79 и 80+ лет), место проживания (город/село), точные даты установления диагноза и смерти, код классификации по Международной классификации болезней 10-го пересмотра, стадия заболевания в соответствии с классификацией TNM UICC 8-го издания, морфологический тип в соответствии с кодом ICDО 3.1. Поскольку регистр рака не собирает подробные сведения о лечении, переменная, кодирующая лечение, включала:
- специальное лечение, включая хирургическое (признак намерения радикального подхода);
- специальное противоопухолевое лечение без хирургического (паллиативное);
- нет сведений о лечении.
Методы анализа. Оценивали опухолеспецифическую выживаемость (ОСВ), характеризующую промежуток времени между датой установления диагноза и датой смерти от РМЖ либо осложнений, связанных с его лечением. Сведения о смерти от РМЖ получали из переменной «код причины смерти» (С50.х), доступной в базе данных регистра. Смерти от других видов рака и от причин, не связанных с ЗНО, событиями не считали. Живых пациентов и пациентов, выбывших из-под наблюдения, цензурировали по дате выгрузки верифицированной базы данных минус 2 мес. (1 октября 2022 года) и по дате последней явки соответственно. Временной лаг для оценки статуса больных использовали для обеспечения надежности сведений о смерти больных, учитывая то, что база данных регистра рака обновляется ежемесячно.
Опухолеспецифическую выживаемость оценивали с помощью методов Каплана–Мейера и метода life tables, различия в выживаемости между популяционными подгруппами оценивали с помощью log-rank-метода. Степень влияния на прогноз отдельных факторов, доступных в базе данных регистра, оценивали в одной многофакторной регрессии Кокса. Статистически значимыми считали различия на уровне р < 0,05.
Результаты
Всего в выборке оказалось 9222 записи о РМЖ, зарегистрированные в период с 2000 по 2020 год. Из них 133 случая с нулевой продолжительностью жизни были зарегистрированы посмертно. Согласно правилам Международного агентства по изучению рака, оценка выживаемости в таких случаях не проводится в связи с неизвестным временем течения заболевания. В итоговый анализ вошло 9089 случаев РМЖ.
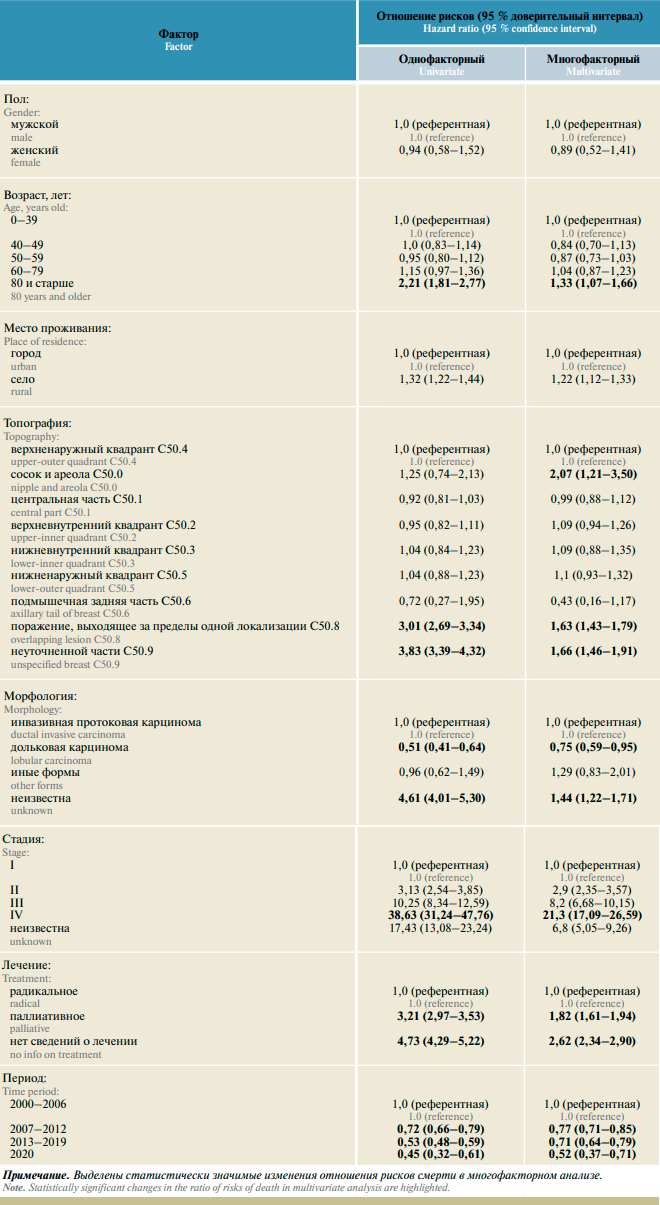
За период наблюдения зарегистрировано 2723 смерти от РМЖ. Показатели 1-, 5- и 10-летней выживаемости во всей популяции составили 91,6% (95% доверительный интервал (ДИ) 91,0–92,2), 73,0% (ДИ 72,0–73,9) и 64,0% (ДИ 62,8–65,2) соответственно. Выживаемость больных РМЖ в зависимости от учитываемых факторов прогноза представлена в табл. 1.
За 21 год в АОКР зарегистрировано 58 случаев РМЖ у мужчин, что составляет 0,6% общей популяции больных. Показатели выживаемости пациентов мужского пола несущественно отличались от таковых в женской популяции.
Другие доступные в регистре факторы существенно определяли прогноз. Так, показатели 5-летней выживаемости у больных 60 лет и старше прогрессивно уменьшались сравнительно с больными моложе 60 лет, особенно эта тенденция прослеживается в пожилом возрасте (80 лет и старше). Проживание в сельской местности также оказывает неблагоприятное влияние на прогноз: 5-летняя выживаемость этих больных на 7% ниже, чем у проживающих в городах (p < 0,05).
Выживаемость больных дольковым РМЖ существенно выше, чем при наиболее часто встречающемся варианте неспецифицированной протоковой карциномы: более 5 лет были живы 83,5 против 74,1% больных. Отсутствие морфологического подтверждения было связано с наименьшим уровнем 5-летней ОСВ. При топографическом расположении опухоли в квадрантах (C50.1–5) 5-летняя выживаемость варьировала в пределах 82,0–79,3%. При редком расположении первичной опухоли в добавочной аксиллярной дольке (С50.6) этот показатель составлял 85,0%, а при исходном поражении соска (С50.0) – 73,6%. Расположение опухоли в 2 и более анатомических областях и неуточненная топография были ассоциированы с наихудшим прогнозом (p < 0,05).
Стадия заболевания является наиболее значимым эпидемиологическим фактором прогноза: более 5 лет были живы 96,6; 86,2; 57,6; 16,1 и 33,7% больных при I, II, III, IV и неизвестной стадиях РМЖ соответственно. Закономерно наиболее высокими были показатели выживаемости у больных РМЖ, получавших радикальное лечение, включавшее хирургическое удаление первичной опухоли. При паллиативном лечении и при отсутствии в регистре сведений о лечении 5-летняя выживаемость была существенно ниже – 59,3 и 43,8% соответственно.
Показатели выживаемости существенно возрастали в течение анализируемого периода. Максимального уровня ОСВ пациентов с РМЖ достигла в период 2013–2019 годов (93,8 и 79,1% для 1- и 5-летнего показателя соответственно). Однолетняя выживаемость больных, получавших лечение в период разгара пандемии COVID-19, в 2020 году, не снижалась сравнительно с предыдущим периодом, составив 95,3%.
Результаты одно- и многофакторного регрессионного анализа ОСВ представлены в табл. 2.
Выживаемость пациентов с РМЖ мужского пола статистически значимо не отличалась от таковой у женщин. Проживание больных РМЖ в сельской местности было связано со значимым увеличением риска смерти от этого заболевания как в одно-, так и в многофакторном анализе – на 32 и 22% соответственно. Риск смерти у пациентов возрастных групп моложе 40, 40–49, 50–59 и 60–79 лет варьировал мало, но был в 2,2 раза в однофакторном и на 33% в многофакторном анализе выше у больных старческого возраста.
Благоприятным фактором можно считать расположение опухоли в аксиллярной добавочной дольке (С50.6): точечное значение отношения рисков после коррекции на все доступные факторы составило 0,43, или в 2,5 раза ниже, чем в референтной группе пациенток с первичной опухолью, расположенной в верхненаружном квадранте, но эти различия статистически незначимы в связи с небольшим числом наблюдений С50.6: такая локализация была выявлена только у 20 больных. В многофакторном анализе риск смерти у пациенток с расположением опухоли в сосково-ареолярной области был в 2 раза выше сравнительно с референтной группой. Прогноз выживаемости значимо ухудшается при расположении опухоли в 1 и более областях и при неуточненном расположении: после коррекции на все доступные факторы риск смерти этих больных был выше на 60–66% сравнительно с другими топографическими кодами.
Риск смерти больных РМЖ с морфологией дольковой карциномы ниже, чем при наиболее частой форме протоковой инвазивной карциномы; отсутствие морфологического подтверждения рака было ассоциировано с более высоким риском смерти (в 4,6 раза), а в многофакторном анализе – на 44% (р < 0,05).
Сравнительно с I стадией РМЖ риск смерти при II, III, IV и неизвестной стадии был выше в 3, 10, 39 и 17 раз соответственно. Поправка на другие факторы в целом не изменила эти соотношения. Отношения рисков смерти от РМЖ составляли 3,2 и 4,7 у пациенток при паллиативном лечении и отсутствии в регистре сведений о лечении по сравнению с больными, чье лечение включало хирургическую операцию. После коррекции на другие факторы они значительно уменьшились, оставшись статистически значимыми.
Риск смерти от РМЖ в периоды 2007–2012 и 2013–2019 годов закономерно статистически значимо снижался по сравнению с референтным периодом 2000–2006 годов. Более того, в период пандемии COVID-19 он был ниже в 2 раза даже после коррекции на другие факторы.
Обсуждение
В эпидемиологическом исследовании, выполненном на сплошной выборке из популяционного канцер-регистра высокого качества, нами были установлены и количественно оценены факторы прогноза выживаемости при РМЖ. Наряду с известными факторами неблагоприятного прогноза, такими как распространенная стадия, пожилой возраст и паллиативный тип лечения [11, 12], риск смерти значимо повышался в случае проживания больных в сельской местности и при расположении первичной опухоли в сосково-ареолярной зоне. С благоприятным прогнозом выживаемости были связаны морфологический вариант дольковой карциномы и редкое расположение в добавочной аксиллярной дольке молочной железы. Риск смерти от РМЖ не повышался у мужчин и во временной период пандемии COVID-19.
В нашем исследовании 5-летняя ОСВ в периоды 2007–2012 и 2013–2019 годов составляла 73,1 и 79,1%, что несколько выше, чем соответствующий показатель нетто-выживаемости 72,4%, зарегистрированный в Архангельской области в период 2010–2014 годов в исследовании CONCORD-3 [4]. Это может быть связано с различиями в подходах к расчету. Относительная, или нетто-выживаемость рассчитывается путем «вычитания» из наблюдаемой выживаемости фоновой смертности от всех причин, поэтому данный индикатор не требует подверженного субъективной оценке кода причины смерти [13] и является наиболее рекомендованным в популяционных эпидемиологических исследованиях. В планах нашей группы сравнить оба подхода в отдельном исследовании.
Возраст старше 80 лет в нашем анализе был ассоциирован с неблагоприятным прогнозом выживаемости. Эти результаты согласуются с данными других популяционных анализов [7, 14]. Изучение факторов, влияющих на неблагоприятный исход у больных пожилого возраста, запланировано в рамках углубленного эпидемиологического анализа.
Пятилетняя ОСВ больных, проживающих в сельской местности, была на 7% ниже, что соответствует повышению риска смерти от РМЖ на 32%. Это частично можно объяснить большей распространенностью РМЖ у этих больных на момент диагностики и более редким назначением радикального лечения, поскольку после поправки на эти факторы в многомерной модели риск смерти снизился до 22%. Требуется углубленный анализ других факторов (назначение специфических методов лечения, маршрутизация, сопутствующая патология и др.) для выявления причин таких существенных различий в выживаемости и выработки конкретных мер для их преодоления. В других эпидемиологических анализах проживание в сельской местности также было связано с неблагоприятным прогнозом [15, 16].
В нашем исследовании установлено независимое неблагоприятное влияние на прогноз расположения первичного очага РМЖ в сосково-ареолярной зоне (С50.0), причем исходно незначимые различия в прогнозе стали статистически достоверными после коррекции на другие эпидемиологические факторы. В доступной литературе мы не смогли найти анализов, включавших расчет риска смерти при этой редкой топографии, однако в недавней публикации по данным SEER было показано, что больные раком Педжета представляют собой обособленную группу, которая требует специальных подходов к диагностике и лечению [17, 18].
Расположение первичной опухоли в аксиллярной дольке (топография С50.6), зарегистрированное только у 20 больных, в нашем эпидемиологическом анализе было ассоциировано с более высокой выживаемостью, чем при других топографиях. Это противоречит результатам, полученным в других популяционных анализах [19, 20]. Учитывая очень незначительное число наблюдений (20 случаев, или 0,2% общей популяции за 22 года), это можно объяснить особенностями кодирования. Вероятно, такой код присваивали только маленьким опухолям, находящимся в пределах этой очень небольшой анатомической области, а при ее распространении на верхненаружный сегмент ей присваивали уже код С50.8. Поражение 2 и более анатомических областей в нашем исследовании было ассоциировано с неблагоприятным прогнозом.
В многофакторном анализе мужской пол был связан с незначимым трендом к повышению риска смерти от РМЖ. В ранее опубликованных анализах мужской пол был ассоциирован с неблагоприятным прогнозом. Так, в основанном на анализе 670 случаев исследовании SEER мужчины с РМЖ имели значительно более низкую выживаемость по сравнению с женщинами: 7-летняя выживаемость составила 77,9 и 89,8% (p < 0,05) соответственно для пациентов, у которых диагноз был установлен за тот же период [19]. Особенно неблагоприятным прогноз выживаемости является при HER2-положительном и трижды негативном молекулярно-биологических вариантах РМЖ у мужчин [20]. В дальнейшем мы планируем проанализировать влияние на выживаемость больных РМЖ, в том числе мужского пола, молекулярно-биологических факторов.
Показатели 1-летней ОСВ при РМЖ не ухудшались в период пандемии COVID-19. Более того, по данным нашего предыдущего анализа, число вновь выявленных случаев и распределение по стадии РМЖ в Архангельской области (АО) существенно не изменялись в этот период [21]. Это согласуется с результатами исследований выживаемости РМЖ, а также при сравнении с другими видами ЗНО [22, 23]. Исследователи связывают улучшение либо неухудшение выживаемости при РМЖ со смертью пациенток старческого возраста от иных причин, в первую очередь от COVID-19. Ограничением этих исследований является короткий промежуток времени (доступен лишь анализ 1-летней ОСВ), в течение которого невозможно полностью проследить все исходы. Требуется последующий анализ в более отдаленном периоде, чтобы оценить последствия пандемии COVID-19 на популяции больных РМЖ в АО.
Архангельский областной канцер-регистр, как и большинство других регистров рака, не собирает потенциально значимую информацию о вредных привычках (употребление алкоголя, табакокурение), персонализированные данные пациентов (рост, масса тела, акушерско-гинекологический анамнез), социально-экономические данные. Более того, в регистре отсутствуют детальные сведения о лечении (вид операции, число удаленных / пораженных лимфатических узлов, конкретные химио- и таргетные препараты, вид, доза и фракционирование лучевой терапии и др.) и молекулярно-биологическом профиле опухоли. Все это ограничивает анализ всех возможных предикторов выживаемости. Детализованные характеристики опухоли доступны в госпитальной базе данных Архангельского клинического онкологического диспансера. В нашем исследовании планируется совмещение госпитальной и эпидемиологической баз для проведения эпидемиологического исследования высокого разрешения.
Выводы
В эпидемиологическом анализе, основанном на сплошной выборке 9089 больных РМЖ, у которых рак был диагностирован в 2000–2020 годах, установлено, что риск смерти от заболевания ассоциирован с более распространенными стадиями, гистологическим вариантом протокового рака (сравнительно с дольковым), локализацией первичного очага в сосково-ареолярной области, а также возрастом старше 80 лет и проживанием в сельской местности. Выживаемость больных РМЖ мужского пола не отличалась от таковой у женщин. В период пандемии COVID-19 выживаемость при РМЖ не ухудшалась, но это требует дальнейшего изучения. Планируется углубленный эпидемиологический анализ молекулярно-биологических и клинических факторов прогноза выживаемости на основе совмещения базы данных регистра с госпитальной базой данных.

Таблица 1. Опухолеспецифическая выживаемость при раке молочной железы в зависимости от факторов, доступных в базе данных регистра рака. Данные Архангельского областного канцер-регистра за 2000–2020 годы
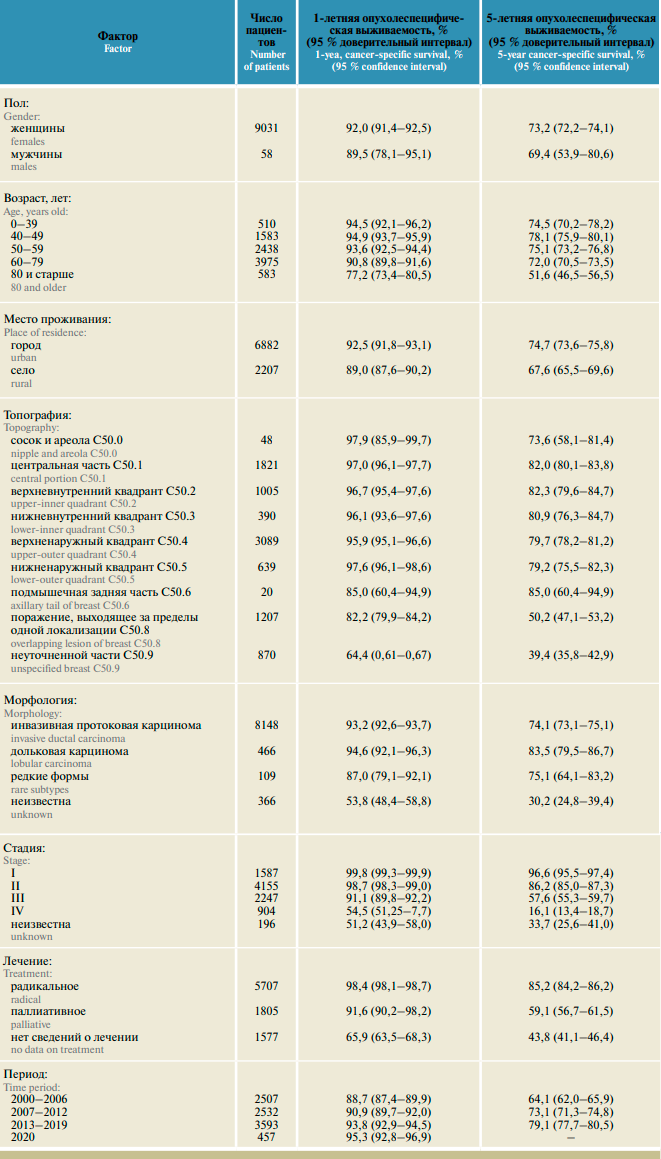
Таблица 2. Одно- и многофакторный регрессионный анализ опухольспецифической выживаемости пациентов с раком молочной железы (регрессия Cox). Данные Архангельского областного канцер-регистра за 2000–2020 годы