
Введение
РМЖ – наиболее часто встречающееся онкологическое заболевание в женской популяции. В мире выявляется более 2 млн случаев ежегодно. В Российской Федерации, по данным последних лет, РМЖ у женского населения – ведущая онкологическая патология (20,9%) и основная причина смертности от злокачественных новообразований (16,2%).
Биологические свойства опухоли в рутинной практике могут оцениваться по таким морфологическим параметрам, как дифференцировка опухоли, пролиферативный статус, лимфоваскулярная инвазия. Однако существуют более точные молекулярные методики оценки генетического профиля опухоли, позволяющие изучить свойства опухоли индивидуально.
Анализ генетического материала с помощью молекулярных методик позволяет выявить новые прогностические и предиктивные маркеры, а также генные сигнатуры, которые превзошли по своей значимости стандартные рутинные методики [1]. Подобные открытия в достаточно короткие сроки формируют новые лечебные и диагностические подходы [2].
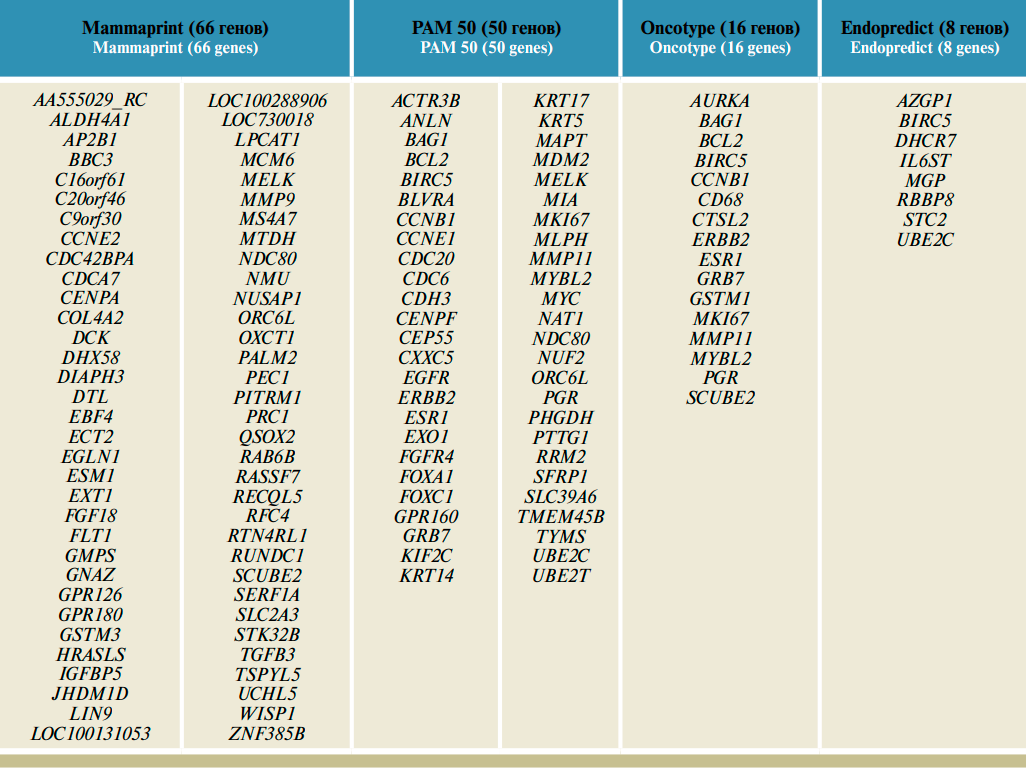
Помимо молекулярных подтипов при статистическом анализе данных генетического исследования опухолей выявлен ряд мультигенных сигнатур. Сигнатуры были выделены на основании экспрессии определенных генов в отдельных подгруппах опухолей. При анализе экспрессии комбинаций этих генов были определены исходы лечения. Мультигенные сигнатуры включают профили генов, которые позволяют прогнозировать отдаленные результаты. Другие генные сигнатуры были выделены при прогнозировании эффекта лечения и используются в качестве предиктивных маркеров. Прогностические сигнатуры – 70-генная сигнатура Mammaprint [3], 76-генная сигнатура [4], геномный индекс степени злокачественности (Genomic Grade Index, GGI) [5], шкала оценки вероятности рецидива из Oncotype DX [6]. Общая черта всех генных сигнатур – комбинации генов, позволяющие сделать прогноз, поскольку, по-видимому, биологическое поведение опухоли имеет генетические предпосылки. Описание наиболее распространенных мультигенных сигнатур приведено в таблице.
Профессиональное сообщество единодушно считает, что мультигенные прогностические тесты обеспечивают полезной информацией, дополняющей традиционные клинико-морфологические характеристики.
Материалы и методы
Молекулярно-генетические исследования образцов ткани РМЖ. В рамках данной части исследования в образцах опухолевой ткани пациенток с метастатическим РМЖ (мРМЖ) изучали экспрессию мРНК 100 генов, участвующих в развитии РМЖ.
Образцы опухолей были предоставлены ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава России, ГБУЗ НО «Нижегородский областной клинический онкологический диспансер», КГБУЗ «Алтайский краевой онкологический диспансер», ОБУЗ «Ивановский областной онкологический диспансер», ГБУЗ СК «Пятигорский межрайонный онкологический диспансер», ГБУЗ СК «Ставропольский краевой клинический онкологический диспансер» (всего 84 образца). У всех пациенток было получено письменное согласие на исследование образцов опухолевой ткани. Назначение лекарственной терапии проводил лечащий врач по данным иммуногистохимического (ИГХ) исследования на основании клинических рекомендаций Минздрава России «Рак молочной железы» [7].
Предварительно в качестве тестового исследования был проведен анализ архивного материала из парафиновых блоков опухолей 12 женщин из 1216 больных с T1–2N0M0 РМЖ, включенных в ретроспективный анализ.
Анализ экспрессии генов проводили с использованием технологии nCounter, основанной на прямой цифровой детекции мишеней с помощью флуоресцентных штрих-кодов (nCounter Analysis System, NanoString Technologies, США) согласно протоколу производителя. Исследуемым материалом являлись образцы опухолевой ткани (биоптаты или операционный материал). Основные этапы технологии nCounter включают гибридизацию, пробоподготовку (отмывку несвязавшихся проб, иммобилизацию проб на картридже, выравнивание в электромагнитном поле), цифровой подсчет штрих-кодов, основанный на детекции отдельных флуоресцентных меток, специфически связывающихся с последовательностями РНК исследуемых проб. Преимущества данной технологии: анализ до 800 мишеней в одной пробе; не требуется предварительная обратная транскрипция и амплификация; высокая воспроизводимость результатов; автоматизированный рабочий процесс; простая обработка данных; низкая чувствительность к качеству образца. Продемонстрирована сопоставимость результатов технологии nCounter c данными количественной полимеразной цепной реакции с обратной транскрипцией, ИГХ-исследования и флуоресцентной гибридизации in situ [8].
Для получения РНК из залитых парафином образцов ткани использовали набор компании Norgen (FFPE Total RNA Purification Kit, Norgen, Канада), выделение и очистка РНК проводились согласно протоколу производителя. Технология основана на хроматографии на спин-колонках с использованием в качестве сепарационной матрицы патентованной смолы Norgen. Достоинством данной методики является очистка РНК от других клеточных компонентов без использования фенола или хлороформа, наличие и недостаточная отмывка которых могут негативно сказываться при дальнейших подсчетах количества РНК. Сначала процесс включал депарафинизацию образцов ткани посредством серии промываний ксилолом и этанолом. Затем образцы ткани гидролизовали протеиназой К и буферным раствором для гидролиза A. Далее к лизату добавляли буферный раствор RL и этанол, полученный раствор загружали на спин-колонку. Смола Norgen связывает нуклеиновые кислоты способом, который зависит от концентраций ионов. Таким образом, с колонкой связывалась только РНК, в то время как другие контаминанты удалялись с потоком или задерживались наверху смолы. Затем связанную РНК промывали прилагаемым раствором для промывания РНК А для удаления каких-либо примесей и очищенную общую РНК элюировали раствором для элюирования А.
Состав изучаемой мультигенной сигнатуры представлен на рис. 1. Выбор генов основан на результатах изучения данных литературы и опыта разработки других мультигенных структур, а также клинической значимости маркеров прогностических шкал.
Рис. 1. Исследуемая 100–генная сигнатура для РМЖ: а – лечебно-ориентированная часть; б – пролиферативно-референсная
Исследования с целью подтверждения мутации генов проводили методами секвенирования нового поколения и полимеразной цепной реакции с обратной транскрипцией в научном отделе биологии опухолевого роста ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
Сравнение результатов оценки типа опухоли с помощью молекулярно-генетического анализа и ИГХ-исследования. Выполнен молекулярно-генетический анализ с использованием технологии nCounter 84 образцов опухоли пациенток пре- и постменопаузального возраста с мРМЖ, которые наблюдались и получали лечение в 6 медицинских учреждениях Российской Федерации (ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, ГБУЗ НО «Нижегородский областной клинический онкологический диспансер», КГБУЗ «Алтайский краевой онкологический диспансер», ОБУЗ «Ивановский областной онкологический диспансер», ГБУЗ СК «Пятигорский межрайонный онкологический диспансер», ГБУЗ СК «Ставропольский краевой клинический онкологический диспансер»).
В рамках исследования был выполнен анализ экспрессии 28 генов с высокой предиктивной значимостью и значительным накопленным опытом изучения по данным литературы (ESR1, PGR, PIK3CA, BCAR4, BCAS2, CCND1, CCND2, CCND3, FOXA1, Erb2, EGFR, CDH3, FOXC1, KRT14, KRT5, CD274, CDK4, CDK6, P53, PTEN, BRCA1, BRCA2, CHEK2, CLDN3, CLDN7, AR, TOP2a, TUBBIII). По результатам анализа был определен молекулярный подтип опухоли, который сравнивали с результатами, полученными при проведении ИГХ-исследования в локальной лаборатории соответствующего медицинского учреждения (суррогатный подтип). Назначение лекарственной терапии проводилось лечащим врачом по данным ИГХ-исследования на основании клинических рекомендаций Минздрава России «Рак молочной железы» [7].
В 2 направленных образцах (№№23, 33) был выявлен фиброз, данные образцы использовались в качестве контроля.
Перед исследованием вышеописанных образцов опухолевой ткани в качестве тестовой реакции был проведен анализ архивного материала из парафиновых блоков опухолей 12 женщин из 1216 больных с T1–2N0M0 эстроген-рецептор-положительным (ЭР+), прогестерон-рецептор-положительным (ПР+), HER2– РМЖ, включенных в ретроспективный анализ. Тепловая карта 12 больных представлена на рис. 2. Интерпретация результатов оценки подтипа опухоли по тепловой карте совпала с результатами ИГХ-исследования, что позволило перейти к исследованию образцов опухолевой ткани у пациенток с мРМЖ.
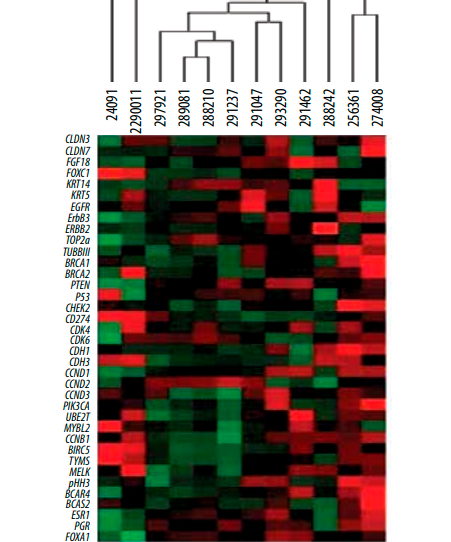
Рис. 2. Тепловая карта: тестовая реакция у 12 пациенток с T1–2N0M0 эстроген-рецептор-положительным, прогестерон-рецептор-положительным, HER2– РМЖ (анализ архивного материала). Цветовой показатель соответствует числовому значению для каждого маркера
Результаты
Оценка экспрессии ESR1, PGR, PIK3CA, ERB2, BRCA1, BRCA2, CD274. Результаты оценки экспрессии 7 генов (ESR1, PGR, PIK3CA, ERB2, BRCA1, BRCA2, CD274), рекомендуемых для исследования клиническими рекомендациями Минздрава России [7], обобщены ниже.
Уровень экспрессии ESR1 варьировал от 52,42 до 86467,64. При сравнительном анализе с результатами ИГХ-исследования ЭР+ статус (ИГХ) расценивался как ложноположительный в случае значений экспрессии ESR1 от 52,42 до 3054,92 (+1), а для ЭР– статуса оценка считалась ложноотрицательной в случае значений экспрессии от 9184,07 (+2) и выше.
Уровень экспрессии PGR варьировал от 41,89 до 86467,64. Уровни 41,89–2058,33, которые отмечались для большинства исследуемых образцов, соответствовали оценке экспрессии «+1», 2058,33–4002,01 – «+2», выше 4002,01 – «+3».
Уровень экспрессии PIK3CA варьировал от 323,59 до 3583,97. Уровни 323,59–1293,65, наблюдаемые для большинства исследуемых образцов, соответствовали оценке экспрессии «+1», 1293,65–2244,04 – «+2», выше 2244,04 – «+3».
Согласно действующим клиническим рекомендациям Минздрава России [7] пациенткам с гормонозависимым HER2– мРМЖ целесообразно определение мутации в гене PIK3CA для выбора оптимальной тактики лекарственной терапии. В связи с этим был проведен генетический анализ (полимеразная цепная реакция в реальном времени, секвенирование по Сэнгеру) 3 образцов опухолевой ткани с ЭР+, ПР+, HER2-статусом и экспрессией гена PIK3CA выше 2244,04, который подтвердил наличие мутации.
Уровень экспрессии ERB2 варьировал от 252,32 до 128519,2. При сравнительном анализе с результатами ИГХ-исследования HER2+ статус (ИГХ) расценивался как ложноположительный в случае значений экспрессии ERB2 от 252,32 до 9196,25 (+1), а для статуса HER2– оценка считалась ложноотрицательной в случае значений экспрессии от 15 022,46 (+2) и выше.
Уровень экспрессии BRCA1 варьировал от 123,8 до 3583,97. Уровни 123,8–583,77, наблюдаемые для большинства исследуемых образцов, соответствовали оценке экспрессии «+1», уровни 583,77–1500,91 – «+2», выше 1500,91 – «+3». У 2 пациенток со статусом опухоли HER2– и экспрессией гена BRCA1 выше 583,77 был проведен генетический анализ методом секвенирования нового поколения и выявлена мутация гена BRCA1.
Уровень экспрессии BRCA2 варьировал от 123,8 до 3583,97. Уровни 123,8–782,16, наблюдаемые для большинства исследуемых образцов, соответствовали оценке экспрессии «+1», уровни 782,16–1303,97 – «+2», выше 1303,97 – «+3».
Уровень экспрессии CD274 варьировал от 36,97 до 3550,56. Уровни 36,94–500,04, наблюдаемые для большинства исследуемых образцов, соответствовали оценке экспрессии «+1», уровни 500,04–1100,17 – «+2», выше 1100.17 – «+3». У 3 пациенток со статусом опухоли HER2– и экспрессией гена CD274 выше 500 по результатам ИГХ-исследования был подтвержден PD-L1-положительный статус опухоли.
Оценка экспрессии BCAR4, BCAS2, CCND1, CCND2, CCND3, FOXA1. Результаты оценки экспрессии генов BCAR4, BCAS2, CCND1, CCND2, CCND3, FOXA1, связанных с гормоночувствительностью и гормонорезистентностью опухоли, обобщены ниже.
Уровень экспрессии BCAR4 варьировал от 9,08 до 678,82. Уровни 9,08–214,37 соответствовали оценке экспрессии «+1», уровни 214,37–3163,766 – «+2», выше 3163,766 – «+3».
Уровень экспрессии BCAS2 варьировал от 1006,72 до 5511,82. Уровни 1006,72–2833,88 соответствовали оценке экспрессии «+1», уровни 2833,88–3378,02 – «+2», выше 33,78,02 – «+3».
Уровень экспрессии ССND1 варьировал от 449,85 до 63718,82. Уровни 449,85–10324,3 соответствовали оценке экспрессии «+1», уровни 10324,3–23160,94 – «+2», выше 23160,94 – «+3».
Уровень экспрессии ССND2 варьировал от 438,32 до 7448,47. Уровни 438,32–2029 соответствовали оценке экспрессии «+1», уровни 2029–3157,54 – «+2», выше 7448,47 – «+3».
Уровень экспрессии ССND3 варьировал от 173,68 до 6763,5. Уровни 173,68–1518,29 соответствовали оценке экспрессии «+1», уровни 1518,29–2087,82 – «+2», выше 2087,82 – «+3».
Уровень экспрессии FOXA1 варьировал от 38,17 до 133744,09. Уровни 38,17–22839,1 соответствовали оценке экспрессии «+1», уровни 22839,21–33634,59 – «+2», выше 33634,59 – «+3».
Оценка экспрессии EGFR, CDH3, FOXC1, KRT14, KRT5. Результаты оценки экспрессии генов EGFR, CDH3, FOXC1, KRT14, KRT5, повышенная экспрессия которых является маркером базального РМЖ, обобщены ниже.
Уровень экспрессии EGFR варьировал от 36,97 до 11125,56. Уровни 36,97–1031,04 соответствовали оценке экспрессии «+1», уровни 1031,04–2843,17 – «+2», выше 2843,17 – «+3».
Уровень экспрессии CDH3 варьировал от 27,39 до 7231,56. Уровни 27,39–1064,04 соответствовали оценке экспрессии «+1», уровни 1064,04–2820,59 – «+2», выше 2820,59 – «+3».
Уровень экспрессии FOXC1 варьировал от 30,79 до 8867,77. Уровни 30,97–1121,59 соответствовали оценке экспрессии «+1», уровни 1121,59–2129,13 – «+2», выше 2129,13 – «+3».
Уровень экспрессии KRT14 варьировал от 2,87 до 56567,54. Уровни 2,87–3087,84 соответствовали оценке экспрессии «+1», уровни 3087,84–17911,44 – «+2», выше 17911,44 – «+3».
Уровень экспрессии KRT5 варьировал от 1,15 до 20332,77. Уровни 1,15–1121,59 соответствовали оценке экспрессии «+1», уровни до 2129,13 – «+2», выше 2129,13 – «+3».
Оценка экспрессии CDK4, CDK6. Результаты оценки экспрессии генов CDK4, CDK6 (иммуномодуляторный РМЖ) обобщены ниже.
Уровень экспрессии CDK4 варьировал от 813,2 до 15607,49. Уровни 813,2–2875,81 соответствовали оценке экспрессии «+1», уровни 2875,81–4458,03 – «+2», выше 4458,03 – «+3».
Уровень экспрессии CDK6 варьировал от 250,51 до 9736,2. Уровни 250,51–1878,93 соответствовали оценке экспрессии «+1», уровни 1878,93–4458,03 – «+2», выше 4458,03 – «+3».
Оценка экспрессии Р53, PTEN, CHEK2. Результаты оценки экспрессии генов P53, PTEN, CHEK2, связанных с развитием наследственной формы РМЖ, обобщены ниже.
Уровень экспрессии P53 варьировал от 208,83 до 9742,76. Уровни 208,83–2485,77 соответствовали оценке экспрессии «+1», уровни 2485,77–3864,35 – «+2», выше 3864,35 – «+3».
Уровень экспрессии PTEN варьировал от 1064,64 до 27368,31. Уровни 1064,64–10455,52 соответствовали оценке экспрессии «+1», уровни 10455,52–14492,47 – «+2», выше 14492,47 – «+3».
Уровень экспрессии CHEK2 варьировал от 127,47 до 3589,97. Уровни 127,47–693,24 соответствовали оценке экспрессии «+1», уровни 693,24–1001,47 – «+2», выше 1001,47 – «+3».
Оценка экспрессии AR. Уровень экспрессии AR варьировал от 28,9 до 18115,38. Уровни 28,9–1770,44 соответствовали оценке экспрессии «+1», уровни 1770,44–4113,61 – «+2», выше 4113,61 – «+3».
Оценка экспрессии CLDN3, CLDN7. Повышенная экспрессия генов CLDN3, CLDN7 обуславливает наличие клаудиноподобного РМЖ.
Уровень экспрессии CLDN3 варьировал от 40,81 до 21225,17. Уровни 40,81–5104,86 соответствовали оценке экспрессии «+1», уровни 5104,86–7700,96 – «+2», выше 7700,96 – «+3».
Уровень экспрессии CLDN7 варьировал от 66,7 до 48720,61. Уровни 66,7–6543,89 соответствовали оценке экспрессии «+1», уровни 6543,89–11029,96 – «+2», выше 11029,96 – «+3».
Оценка экспрессии TOP2a, TUBBIII. Результаты оценки экспрессии генов TOP2a, TUBBIII, отвечающих за чувствительность к химиотерапии антрациклинами и таксанами, обобщены ниже.
Уровень экспрессии TOP2a варьировал от 454,33 до 4080,08. Уровни 454,33–1851,11 соответствовали оценке экспрессии «+1», уровни 1851,11–2292,96 – «+2», выше 2292,96 – «+3».
Уровень экспрессии TUBBIII варьировал от 25,71 до 3583,97. Уровни 25,71–1523,89 соответствовали оценке экспрессии «+1», уровни 523,89–811,03 – «+2», выше 811,03 – «+3».
По результатам сравнения было выявлено 29 случаев (29/84; 34,5%) расхождения оценки подтипа опухоли. В 11 случаях (образцы №№2, 8, 14, 21, 24, 40, 41, 52, 58, 70, 77) расхождения относились к люминальным А и В подтипам РМЖ, что может оказать влияние на выбор оптимальной лекарственной терапии, однако при любой тактике назначенное лечение будет соответствовать утвержденным клиническим рекомендациям [7]. В 18 случаях (образцы №№4, 9, 15, 16, 25, 34, 35, 37, 38, 45, 47, 53, 57, 65, 76, 78, 80, 83) расхождения относились к подтипам опухоли РМЖ, для которых рекомендуются принципиально различные схемы лекарственной терапии [7].
Обсуждение
Одним из актуальных вопросов современной онкологии является проблема прогнозирования течения и исхода злокачественных новообразований с целью предсказания развития прогрессирования заболевания и проведения коррекции противоопухолевой терапии. Важным направлением в исследованиях является поиск новых, более точных и достоверных способов прогноза, основанных на оценке не единичного фактора прогноза, а совокупности нескольких различных клинических, биологических, морфологических, иммунологических и других факторов и определении прогностической значимости каждого из них [5, 9, 10, 11, 12].
Экспрессия гена – технический термин, обозначающий активность гена. Активность оценивается с помощью подсчета молекул мРНК в определенном типе клеток или ткани. Экспрессия всех генов в конкретном образце называется генетическим профилем (генной сигнатурой, генетическим портретом), большинство опухолей демонстрируют определенные профили экспрессии, связанные со специфическими биологическими свойствами [13, 14].
Молекулярная и иммуногистохимическая классификации совпадают лишь частично. Методики, позволяющие более точно определять принадлежность опухоли к тому или иному молекулярному подтипу, постоянно совершенствуются как для фундаментальных исследований, так и для рутинных клинических потребностей.
Выделение молекулярных подтипов прежде всего имеет клиническое значение. Классификация используется как для формирования прогноза у каждого конкретного пациента, так и для выбора адъювантной терапии или метода лечения диссеминированной болезни.
G. Viale и соавт. оценили корреляцию между результатами определения мРНК ЭР, ПР, HER2 с помощью методики TargetPrint, результатами стандартного ИГХ-исследования и флуоресцентной гибридизации in situ у 800 пациентов, принявших участие в исследовании MINDACT [15]. В исследование были включены пациенты со стадией T1–2 или резектабельной стадией T3, количеством пораженных лимфатических узлов от 0 до 3. Для ЭР частота совпадения положительных результатов, полученных с помощью теста TargetPrint и при стандартной оценке, составила 98%, частота совпадения отрицательных результатов – 96%. При оценке ПР частота совпадения положительных результатов составила 83%, отрицательных результатов – 92%. При оценке HER2 частота совпадения положительных результатов составила 75%, отрицательных результатов – 99%. Частота несовпадения результатов составила 6,7% для ЭР, 12,9% для ПР, 4,3% для HER2. Результаты оценки с помощью микрочипа TargetPrint в значительной степени совпадают с результатами стандартного ИГХ-исследования и флуоресцентной гибридизации in situ в исследовании MINDACT. Следовательно, методика TargetPrint является надежным методом анализа экспрессии данного рецептора и может повышать надежность результатов определения экспрессии ЭР, ПР, HER2 [15].
В рамках определения подтипов РМЖ с помощью ИГХ-методов наиболее остро стоит вопрос о базальноподобном РМЖ. Несмотря на то что ТНРМЖ характеризуется отсутствием экспрессии ЭР, ПР, HER2, консенсус по вопросу об использовании суррогатных ИГХ-маркеров для диагностики базальноподобного рака не достигнут. ТНРМЖ и базальноподобный РМЖ характеризуются неблагоприятным прогнозом, и выбор вариантов лечения для них невелик. Различные ИГХ-маркеры использовались для определения базального фенотипа: отсутствие экспрессии ЭР, ПР, HER2, экспрессия 1 или более базальных цитокератинов (CK5/6, CK14, CK17); для ТНРМЖ – экспрессия CK5/6 и/или EGFR [16, 17, 18]. Сравнительных исследований базальноподобного подтипа на основании генетического профиля экспрессии и ТНРМЖ, подтвержденного ИГХ-методами, недостаточно. Базальноподобный подтип встречается в 15–20% случаев во всех исследованиях. Таким образом, относительно редкая частота затрудняет достижение консенсуса. F.M. Blows и соавт. провели метаанализ более чем 10 000 случаев РМЖ и продемонстрировали наибольшую эффективность использования 5 маркеров для определения молекулярных подтипов РМЖ, включая базальноподобный [19]. В ряде исследований продемонстрирован более неблагоприятный прогноз при базальноподобном подтипе, чем при ТНРМЖ [16, 20, 21].
Тактика терапии при ТНРМЖ долгое время оставалась неопределенной, однако результаты недавнего метаанализа подтверждают эффективность платиносодержащей терапии по сравнению со схемами без препаратов платины по показателям частоты полной патологической ремиссии (pCR), объективного общего ответа, выживаемости без прогрессирования, безрецидивной и общей выживаемости у пациенток с ТНР-МЖ без мутации BRCA, что подтверждает важность профилирования опухоли для индивидуализации лечения [22]. В исследовании, выполняемом с использованием сигнатуры РАМ50, было показано преимущество карбоплатина против доцетаксела по параметру объективного общего ответа при базальноподобном ТНРМЖ с герминальной мутацией BRCA1, при этом доцетаксел показал более высокую эффективность в подгруппе пациенток с небазальноподобным ТНРМЖ [22].
Результаты недавних клинических исследований позволяют индивидуализировать назначение терапии при выявлении мутаций генов BRCA1/2. В исследовании III фазы OlympiA с включением 1836 больных с ранним РМЖ, выявленными патогенными мутациями генов BRCA1/2 и высоким риском рецидива на промежуточном анализе после 2,5 года наблюдения было показано, что при терапии олапарибом в дозе 300 мг 2 раза в день в течение 1 года после полностью завершенного локального и системного лечения (неоадъювантной и/или адъювантной химиотерапии) 3-летняя выживаемость без инвазивных заболеваний составила 85,9% в группе олапариба и 77,1% в группе плацебо (разница 8,8%; 95% доверительный интервал (ДИ) 4,5–13,0; отношение рисков (ОР) для инвазивного заболевания или смерти 0,58; 99,5% ДИ 0,41–0,82; p < 0,001). Трехлетняя выживаемость без отдаленного заболевания составила 87,5% в группе олапариба и 80,4% в группе плацебо (разница 7,1%; 95% ДИ 3,0–11,1; ОР для отдаленного заболевания или смерти 0,57; 99,5% ДИ 0,39–0,83; р < 0,001). Профиль безопасности олапариба соответствовал ранее полученным данным [23]. Кроме того, показана эффективность олапариба при наличии мутаций gPALB2 [24]. В исследовании EMBRACA талазопариб оказался более эффективным, чем терапия по выбору врача, у пациентов с мРМЖ и мутацией гена BRCA. Выживаемость без прогрессирования составила 8,6 и 5,6 мес. в группах талазопариба и химиотерапии соответственно (ОР 0,54; 95% ДИ 0,41–0,71; p < 0,0001) [8, 25].
Исследование II фазы TBCRC 048 показало эффективность терапии олапарибом при герминальной мутации PALB2 и соматической мутации BRCA1/2 [24]. В настоящее время популяция пациентов, которые могут получить пользу от PARPi, выходит за рамки носителей мутации gBRCA1/2 и включает пациентов с мутациями gPALB2 и sBRCA1/2.
По данным метаанализа, проведенного в 2018 году, высокая экспрессия EGFR обнаруживается у 27% пациентов с ранним РМЖ. У больных ТНРМЖ с гиперэкспрессией EGFR показатели безрецидивной и общей выживаемости были существенно ниже в сравнении с ТНРМЖ без гиперэкспрессии EGFR [26].
В течение последних лет проводятся исследования по изучению анти-EGFR-препаратов при РМЖ, в частности ингибиторов тирозинкиназы, однако препараты, одобренные для применения в рутинной клинической практике, отсутствуют [27].
Высокая экспрессия гена CD274, отвечающего за синтез PD-L1, обусловливает необходимость назначения атезолизумаба (препарата анти-PD-L1-моноклональных антител) [7].
Недавние результаты исследования KEYNOTE-355 продемонстрировали эффективность комбинации химиотерапии с препаратом анти-PD-L1-моноклональных антител пембролизумабом у пациентов с распространенным ТНРМЖ с PD-L1-положительным статусом (combined positive score (СPS) > 10), определенным с помощью теста DACO 22C3 [28].
Согласно рекомендациям NCCN 2022 [29] и ASCO/CAP 2020 [30], пациентки с низким уровнем экспрессии ЭР (1–10%) могут получить эффект от эндокринной терапии, однако биологическое поведение некоторых карцином с низкой экспрессией ЭР более схоже с таковым ЭР– карцином, поэтому этот результат в настоящее время следует считать сомнительным, течение заболевания более близко к таковому при ЭР– РМЖ, что должно учитываться при выборе лечебной стратегии.
В исследовании B.S. Sheffield и соавт. [31] в группе ЭР (1–10%), по результатам РАМ50, люминальный HER2– рак составляет только 10%, базальный и HER2+ подтипы – 90%. Эти результаты существенно не отличаются от доли люминальных подтипов, выявленных в когорте ИГХ ЭР– опухолей молочной железы (5% люминальных, 95% нелюминальных). Показатели безрецидивной и общей выживаемости были одинаковыми в обеих группах (р = 0,4 и 0,5 соответственно), несмотря на адъювантную гормональную терапию, назначенную в большинстве (59%) слабоположительных случаев ЭР. В ретроспективном исследовании M. Yi и соавт. [32] на основании анализа данных 9369 больных РМЖ также были получены результаты, свидетельствующие о неэффективности гормонотерапии как у пациенток с низкой экспрессией ЭР, так и у пациенток с ЭР– статусом.
При РМЖ примерно 70% опухолей экспрессируют ЭР, что обусловливает их чувствительность к гормональному воздействию. Гормонотерапия – важный метод лечения как резектабельного, так и диссеминированного РМЖ. Существует ряд механизмов развития резистентности к гормонотерапии. Актуальные исследования свидетельствуют о том, что ключевую роль в развитии резистентности играет мутация гена ЭР ESR1. Большинство мутаций этого гена (80%) располагаются в зоне лигандсвязывающего домена, включающего кодоны 534–538: D538G, Y537N/C/S, E380Q [33, 34]. Данные мутации являются приобретенными, практически полностью отсутствуют при первичном РМЖ (< 2% случаев) и возникают в метастатических опухолях у 25–30% пациентов на фоне терапии ингибиторами ароматазы. На первый взгляд, данная мутация может быть маркером резистентности к ингибиторам ароматазы. Однако результаты исследований свидетельствуют о том, что выявление мутации ESR1 является независимым фактором неблагоприятного прогноза в отношении как безрецидивной, так и общей выживаемости.
Масштабные генетические исследования, такие как «Атлас ракового генома» (The Cancer Genome Atlas), способствовали обновлению представлений о генетической основе РМЖ [35].
Несмотря на ключевую роль ЭР в развитии люминального РМЖ, мутации гена ESR1 возникают только лишь в 0,5% случаев, амплификации гена ESR1 встречаются в 2,6% случаев. Методом цифровой полимеразной цепной реакции при исследовании 270 случаев раннего РМЖ T. Takeshita и соавт. установили, что частота мутации ESR1 составляет 2,5% [36]. P. Wang и соавт. заявили о более высокой частоте – 7% [37].
R. Jeselsohn и соавт. сравнили частоту мутаций при мРМЖ и ЭР+ раннем РМЖ. Частота мутаций всех исследованных генов при мРМЖ и раннем РМЖ была одинаковой, за исключением гена ESR1. Это позволяет предположить, что данная мутация играет важную роль в развитии метастатической болезни [33].
Оценка мутации PIK3CA позволяет индивидуализировать тактику лечения пациенток с РМЖ. Результаты III фазы рандомизированного исследования SOLAR-1 продемонстрировали преимущество комбинации алпелисиба с фулвестрантом по сравнению с монотерапией фулвестрантом у пациентов с распространенным РМЖ HR+/HER2– с наличием мутации PIK3CA в опухоли, выразившееся в увеличении медианы выживаемости без прогрессирования (11,0 мес. против 5,7 мес., р < 0,001), увеличении частоты объективных ответов (26,6% против 12,8%), в том числе и у пациентов с измеряемыми очагами (35,7% против 16,2%). Комбинация алпелисиба с фулвестрантом показала значимую эффективность по сравнению с одним фулвестрантом в 1–2-й линии терапии, в том числе у пациенток, получавших лечение CDK4/6-ингибиторами [38].
HER2+ РМЖ характеризуется экспрессией при ИГХ-исследовании либо амплификацией при гибридизации in situ. Гиперэкспрессия HER2 – показание к применению анти-HER2-терапии.
Регистрация и внедрение в клиническую практику препаратов из группы конъюгатов моноклональных антител (antibody-drug conjugates, ADC), демонстрирующих эффективность при низком уровне экспрессии HER2, обусловливают важность точного определения HER2-статуса опухоли. В исследовании DESTINY-Breast04 [39] трастузумаб дерукстекан (ADC-препарат) продемонстрировал снижение риска прогрессирования заболевания или смерти на 50% (ОР 0,50; 95% ДИ 0,40–0,63; p < 0,0001) у пациентов с HER2-слабоположительным мРМЖ как с положительным, так и с отрицательным статусом гормональных рецепторов. В группе трастузумаб дерукстекана медиана выживаемости без прогрессирования составила 9,9 мес. по сравнению с 5,1 мес. в группе химиотерапии. При применении трастузумаба дерукстекана, по сравнению с химиотерапией, наблюдалось статистически значимое уменьшение риска смерти (ОР 0,64; 95% ДИ 0,49–0,84; p = 0,001), при этом медиана общей выживаемости составила 23,4 и 16,8 мес. соответственно.
Сведения об индивидуальном профиле опухоли расширяют представления о гетерогенности опухолевого процесса, позволяют проводить сбор данных предиктивной и прогностической значимости отдельных биомаркеров и формировать базу для развития персонализированного подхода терапии РМЖ.
Представляется целесообразным продолжение исследований разработанных прогностических шкал и накопление данных рутинной клинической практики о группах риска больных РМЖ, выборе терапии и оценке ее эффективности.
Заключение
Изучение данных литературы и выполненные работы по оценке клинической значимости маркеров прогностических шкал позволили разработать 100-генную сигнатуру, включающую молекулярные подтипы РМЖ (люминальный А, люминальный В, базальный, клаудиноподобный) и лечебно-ориентированные кластеры. Мультигенная сигнатура состоит из пролиферативно-референсной части (58 генов), лечебно-ориентированной части (37 генов) и референса (5 генов).
В рамках исследования сравнивали молекулярный подтип опухоли, определенный с помощью разработанной мультигенной сигнатуры, и результаты, полученные при проведении ИГХ-исследования. Молекулярно-генетический анализ с использованием технологии nCounter 84 образцов опухоли пациенток пре- и постменопаузального возраста с мРМЖ, в рамках которого была проведена оценка экспрессии 28 генов с высокой предиктивной значимостью (ESR1, PGR, PIK3CA, BCAR4, BCAS2, CCND1, CCND2, CCND3, FOXA1, ERBB2, EGFR, CDH3, FOXC1, KRT14, KRT5, CD274, CDK4, CDK6, P53, PTEN, BRCA1, BRCA2, CHEK2, CLDN3, CLDN7, AR, TOP2a, TUBBIII), выявил 29 случаев (29/84; 34,5%) расхождения оценки подтипа опухоли в сравнении с результатами ИГХ-исследования, из них в 18 случаях (18/84; 21%) расхождения относились к подтипам опухоли РМЖ, для которых рекомендуются принципиально различные схемы химиотерапии.
Изучение образцов опухолевой ткани с использованием технологии nCounter позволило описать для каждого из выбранных 28 генов уровни экспрессии, соответствующие оценкам «+1», «+2» и «+3». Исследуемый перечень генов включал:
- 7 генов, рекомендуемых для исследования клиническими рекомендациями Минздрава России (ESR1, PGR, PIK3CA, ERB2, BRCA1, BRCA2, CD274) [7];
- гены BCAR4, BCAS2, CCND1, CCND2, CCND3, FOXA1, связанные с гормоночувствительностью и гормонорезистентностью опухоли;
- гены EGFR, CDH3, FOXC1, KRT14, KRT5, повышенная экспрессия которых является маркером базального РМЖ;
- гены CDK4, CDK6 (иммуномодуляторный РМЖ);
- гены P53, PTEN, CHEK2, связанные с развитием наследственной формы РМЖ;
- ген AR;
- гены CLDN3, CLDN7 (клаудиноподобный РМЖ);
- гены TOP2a, TUBBIII, отвечающие за чувствительность опухоли к химиотерапии антрациклинами и таксанами.
Кроме того, выполненные работы позволили установить для генов ESR1 и ERBB2 диапазоны уровней экспрессии, соответствующие ложноположительным и ложноотрицательным результатам ИГХ-исследований статуса опухоли в отношении ЭР и HER2-рецепторов, что позволяет обеспечить выбор оптимальной тактики лечения.
В настоящем исследовании была показана сопоставимость результатов определения экспрессии генов с использованием технологии nCounter с данными генетического исследования на мутации соответствующего гена. Так, в образцах опухолевой ткани с высокой экспрессией генов PIK3CA и BRCA1 генетические анализы с использованием методов полимеразной цепной реакции в реальном времени и секвенирования нового поколения подтвердили наличие соответствующих мутаций. В образцах с высокой экспрессией гена CD274 ИГХ-анализ подтвердил PD-L1+ статус опухоли. Полученные результаты согласуются с данными других работ, в которых также была продемонстрирована сопоставимость результатов технологии nCounter c данными количественной полимеразной цепной реакции с обратной транскрипцией, ИГХ-исследования и флуоресцентной гибридизации in situ [8].
Изучение индивидуальных молекулярно-генетических профилей опухолевых образцов, имеющих одинаковый суррогатный подтип по данным ИГХ-анализа (HER2–, ЭР+ статус и HER2– и ЭР– статус), выявило случаи клинически значимых различий характеристик опухоли, несмотря на сходный результат оценки на основании ИГХ-анализа. В опухолевых образцах с HER2–, ЭР+ статусом индивидуальные характеристики опухолей включали более высокую экспрессию ESR1 и маркеров неблагоприятного прогноза (PIK3CA, P53, CCND1, BCAS2, FOXA1), а в образцах с HER2– и ЭР–статусом – гиперэкспрессию генов KRT5 и CDH3, являющихся маркером базального РМЖ; гиперэкспрессию генов EGFR и CD274, требующих соответствующей лечебной тактики с назначением анти-EGFR-препаратов и анти-PD-L1-моноклональных антител; повышенную экспрессию маркеров базального РМЖ (CDH3, FOXC1, KRT14) и клаудиноподобного РМЖ (CLDN3, CLDN7), обусловливающих более агрессивное течение РМЖ; повышенную экспрессию генов TOP2α и TUBBIII, которые могут служить маркерами чувствительности к антрациклиновым антибиотикам и таксанам.

Мультигенные сигнатуры
Perez E.A. Abstract S1-06: Stromal tumor-infiltrating lymphocytes (S-TILs): in the alliance N9831 trial S-TILs are associated with chemotherapy benefit but not associated with trastuzumab benefit. Cancer Res 2015;9(75 Suppl):S1-06-S1-06



















