Введение
РМЖ – наиболее часто встречающееся онкологическое заболевание в женской популяции. Более 2 млн случаев в мире выявляют ежегодно. В России, по данным последнего десятилетия, РМЖ у женского населения является ведущей онкологической патологией (20,9%) и основной причиной смертности от злокачественных новообразований (16,2%). В период с 2008 по 2018 г. абсолютное число впервые выявленных случаев РМЖ увеличилось с 52 469 до 70 682, показатель заболеваемости на 100 тыс. населения вырос с 42,83 до 51,63 случая. По состоянию на 2018 г. в структуре онкологической заболеваемости РМЖ занимает 1-е место у женщин в возрасте 30–59 лет (27,2%), 2-место – у женщин в возрасте 60 лет и старше (18,1%) и 3-е место у лиц в возрасте 0–29 лет (7,0%) [1].
За последние десятилетия смертность от РМЖ в мире несколько снизилась благодаря широкому внедрению маммографического скрининга, адъювантной и неоадъювантной системной терапии [2]. В то же время современный подход к выбору адъювантной терапии существенно отличается от принятого в прошлом. Адъювантная химиотерапия, ранее рассматриваемая в качестве обязательной при определенных клинических условиях, уже не является общепринятым стандартом лечения.
Биомаркеры играют важнейшую роль в лечении РМЖ. В настоящее время маркеры перестают рассматриваться в рамках привычного перечня (эстрогеновые рецепторы (ЭР), прогестероновые рецепторы (ПР), рецептор эпидермального фактора роста (HER2)). Маркером может считаться параметр, отражающий нормальный биологический процесс, патологический процесс, ответ на терапевтическое вмешательство [3]. Гистологические, иммуногистохимические, физиологические и радиологические параметры могут быть биомаркерами. Американским обществом клинической онкологии (American Society of Clinical Oncology, ASCO) опубликованы рекомендации по клиническому использованию биомаркеров (помимо системы TNM) для выбора терапии при диссеминированном РМЖ [4] и адъювантной терапии при ранних стадиях РМЖ [5]. Несмотря на растущее число маркеров, используемых в клинической практике, пока их существенно меньше тех, что находятся на стадии изучения. Это обусловлено определенными трудностями внедрения маркеров в рутинную практику.
На основании достижений последних генетических исследований получено представление о генетическом многообразии РМЖ, благодаря чему стало возможным выделение молекулярных подтипов РМЖ с характерными для них факторами риска, морфологическими признаками, особенностями ответа на лечение, отдаленными результатами, что впоследствии позволило разработать более адекватные терапевтические подходы к каждому из них.
В настоящее время методики анализа молекулярно-генетического профиля опухоли позволяют детально изучить свойства опухоли, а оценка экспрессии генов – выделить группу благоприятного прогноза среди больных HER2 – РМЖ с наличием экспрессии ЭР, которые не нуждаются в адъювантной химиотерапии. Доля больных с благоприятным прогнозом в данной группе может составлять не менее 40%. Однако внедрение молекулярно-генетического профилирования опухоли в рутинную практику затруднено из-за высокой стоимости теста и отсутствия полученных в проспективных исследованиях доказательств прогностической и предиктивной ценности для выбора адъювантного лечения. Именно пациентам с ЭР + HER2– РМЖ может проводиться неоптимальная, избыточная химиотерапия. Суррогатное определение подтипов РМЖ на основании оценки уровня экспреcсии ЭР, ПР, HER2, Ki-67 с помощью иммуногистохимических (ИГХ) методов эффективно с точки зрения формирования индивидуального прогноза и выбора адъювантного лечения [6]. Это доказывает ряд исследований, в которых определение подтипа опухоли проводилось с помощью суррогатных маркеров одновременно с анализом генетического профиля опухоли [7].
Все более актуальным становится изучение биологических маркеров РМЖ, являющихся альтернативой стандартным маркерам, которые широко применяются в рутинной клинической практике. Целый ряд показателей, таких как р53 [8], CK5/6 [9], SMA [10], p63 [11], PHH3 [12], Е-кадгерин (E-cadherin) [13], EGFR [14], FOXA1 [15], андрогеновые рецепторы (AR) [16], TILs [17] и др., в многочисленных исследованиях демонстрируют предиктивную и/или прогностическую значимость. Это свидетельствует о том, что новые биологические маркеры РМЖ требуют дальнейшего подробного изучения. Результаты подобных исследований в будущем могут существенно повлиять на формирование новых подходов к лечению РМЖ.
Материалы и методы
План работы и общее описание дизайна исследования. Для проведения комплексных многоплановых исследований была разработана программа, которая включала следующие этапы:
- Сбор первичной информации, анализ данных литературы по клиническим, патоморфологическим, прогностическим и предиктивным факторам при РМЖ.
- Выбор исследуемой группы, сбор и обработка данных для оценки изучаемых анамнестических, клинических, патоморфологических и иммуногистохимических параметров (ретроспективное когортное исследование данных канцер-регистра).
- Гистологические, иммуногистохимические исследования образцов ткани пациенток с РМЖ (ретроспективное когортное исследование).
- Статистический анализ данных и интерпретация полученных результатов.
- Разработка и внедрение способа многофакторного прогноза РМЖ.
Исследование было одобрено комитетом по этике ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова» Минздрава России.
Ретроспективный анализ данных канцер-регистра. Проведено ретроспективное исследование, в рамках которого были проанализированы данные, полученные из объединенного канцер-регистра по РМЖ ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова» Минздрава России (Санкт-Петербург) за 2000–2012 гг.
Данные для расчета показателей безрецидивной и общей выживаемости были получены путем приглашения больных на периодические обследования, посредством прямых телефонных контактов с больными или их родственниками, путем выкопировки из амбулаторных карт, а также извлечены из базы данных о льготных категориях населения, баз данных отделов ЗАГС и МВД Санкт-Петербурга. Информация о выживаемости была получена в 85–92% случаев (в зависимости от года лечения пациентки).
Для целей настоящего исследования был проведен ретроспективный анализ данных пациенток из канцер-регистра, имеющих T1–2N0M0 стадию на момент операции. Общая численность исследуемой популяции составила 1216 женщин. План анализа включал оценку следующих анамнестических, клинических, патоморфологических и иммуногистохимических данных канцер-регистра о пациентках исследуемой популяции: возраст на момент операции, стадия pTNM, размеры опухоли до лечения, вид неоадъювантной и адъювантной терапии, длительность наблюдения после операции, данные о рецидиве и выживаемости, степень гистологической злокачественности по Elston–Ellis, уровень экспрессии ЭР, ПР, HER2 (в случае отсутствия результатов лабораторных исследований в регистр вносились и затем анализировались данные, полученные по результатам анализа архивных материалов).
Основные характеристики пациенток исследуемой популяции приведены в табл. 1. Как видно из представленных результатов, средний (± SD) возраст пациенток на момент операции составлял 55,66 ± 10,90 года (диапазон 24–84 года), средний размер опухоли до лечения – 2,24 ± 0,87 см (диапазон 0,5–5,0 см), максимальный размер опухоли – 2,33 ± 1,00 см (диапазон 0,30–15,00 см).
Средние (± SD) значения оцениваемых маркеров составили: клеточная плотность – 5887,61 ± 3192,83 клетки / мм 2, уровень экспрессии ЭР – 3,80 ± 3,94 балла, ПР – 3,21 ± 3,79 балла, индекс пролиферации Ki-67 – 20,02 ± 20,96%.
Медиана длительности наблюдения пациенток после операции составила 12 лет.
Летальный исход был зарегистрирован у 206 (16,9%) из 1216 пациенток. Адъювантную (послеоперационную) терапию получили 1034 (85,0%) женщины, 182 (15,0%) пациентки находились под наблюдением.
Гистологические и иммуногистохимические исследования образцов ткани РМЖ. Гистологические и иммуногистохимические исследования были выполнены в лаборатории ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова» Минздрава России. В рамках настоящей работы проведен анализ архивного материала из парафиновых блоков опухолей исследуемой популяции (1216 больных РМЖ T1–2N0M0).
Для иммуногистохимических исследований архивный материал был окрашен антителами как к широко использующимся в настоящее время маркерам (ЭР, ПР, HER2, Ki-67), так и к малоизученным (CK14, FOXA1, FOXP3, PD-L1, P53, актин гладкомышечный (SMA), AR, E-cadherin, CD4, CD8, CK5 / 6, EGFR). Анализ образцов ткани проводился с использованием метода тканевых матриц. Характеристики используемых методик для каждого вида маркера представлены в табл. 2.
Методы статистического анализа. Для описания количественных показателей применялись среднее значение и стандартное отклонение (M ± SD). Качественные показатели представлены в виде частот и долей в процентах. 95% доверительные интервалы (ДИ) вокруг точечной оценки также представлены (где применимо).
Статистическая обработка данных осуществлялась с помощью пакетов прикладных программ Statistica 10 и SAS JMP 11.
Результаты
Анализ распределения прогностических и предиктивных маркеров РМЖ. Для целей настоящего исследования были проанализированы данные 1216 пациенток с T1–2N0M0 РМЖ. В исследуемой популяции преобладали женщины в возрасте ≥50 лет (69,1%). Оценка по системе TNM продемонстрировала преобладание стадии T1N0M0 (55,2%). Стадия T2N0M0 была верифицирована у 44,8% когорты. У 52,0% пациенток размер опухоли составлял более 2 см, у 46,2% – от 1 до 2 см, у 1,8% – менее 1 см.
При анализе гистологической злокачественности новообразований было установлено преобладание прогностически неблагоприятных степеней G 2 (47,5%) и G3 (36,9%) опухолевого процесса, доля начальной степени формирования опухоли G1 была наименьшей (15,6%).
HER2+-статус наблюдался у 8,7% женщин (иммуногистохимическая категория 3+), категория 0 (отсутствие экспрессии HER2) установлена у 70,6%, категория 1+ – у 11,5%, категория 2+ – у 9,2% женщин.
В данном исследовании у 45,7% женщин степень положительного окрашивания на ЭР достигла 7–8 баллов. Максимальная экспрессия ПР была установлена в 35,4% случаев.
Уровень Ki-67 был 5% и более у 76,9% женщин, при этом примерно у половины пациенток (47,7%) уровень Ki-67 превысил 13%.
Таким образом, внутри когорты с исходно сопоставимыми клиническими критериями опухоли (T1–2N0М0) регистрировался значительный разброс в распределении прогностических и предиктивных маркеров.
В рамках настоящего исследования анализ распределения редких маркеров в группах пациенток младше и старше 50 лет не выявил статистически значимых различий (табл. 3).
Разработка моделей прогностических шкал. Первый этап оценки включал однофакторный анализ факторов риска летального исхода для комплекса показателей. На основе полученных данных выбирались наиболее значимые со статистической и клинической точек зрения факторы, влияющие на параметр летального исхода. Среди них на основе логистической регрессии были выбраны 10 факторов, которые оказывают наибольшее влияние на данную переменную. Результаты пошаговой логистической регрессии представлены в табл. 4.
Исходя из выделенных факторов были построены балльные шкалы с разным количеством факторов. Шкалы строились следующим образом: за каждый фактор, который присутствует у пациентки, начислялось по 1 баллу, при отсутствии данных – 0,5 балла. Названия шкал соответствовали количеству факторов, входящих в шкалу. Факторы всегда выбирались по порядку на основании влияния на прогнозируемую переменную «летальный исход». Сравнение этих шкал для использования в качестве модели с разрабатываемыми шкалами риска рецидива представлено в табл. 5.
На основании 3 шкал (шкалы 8, 9 и 10) были построены 100-балльные модели «регрессия 8», «регрессия 9», «регрессия 10» соответственно. Проведено сравнение всех моделей для прогнозирования целевого показателя. Полученные результаты позволяют сделать вывод о том, что предложенные балльные регрессионные шкалы имеют лучшие показатели, чем традиционная шкала. Прогностической моделью, наилучшим образом предсказывающей 10-летнюю выживаемость, является регрессионная шкала («регрессия 10»).
Регрессионная прогностическая шкала. Регрессионная прогностическая шкала (патент на изобретение No 2763839 C1 от 11.01.2022 [18]) приведена в табл. 6.
Согласно количеству набранных баллов, все пациентки были разделены на 3 группы риска летального исхода: до 40 баллов – низкий риск, от 40 до 60 баллов – средний риск, более 60 баллов – высокий риск. Распределение пациенток исследуемой популяции на группы риска по регрессионной шкале представлено на рис. 1. Высокий риск прогрессирования злокачественного процесса был верифицирован только у 11,3% участниц исследования.
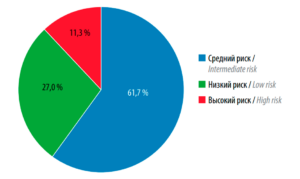
Рис. 1. Распределение пациенток по группам риска на основании оценки по регрессионной шкале
Анализ рецепторного статуса опухоли в когортах с разным прогностическим риском по количеству баллов показал, что низкий риск прогрессирования злокачественного процесса у 85,53% женщин был ассоциирован с положительным стероидным статусом (ЭР+ / ПР±) и HER2– (рис. 2). Доля данного типа опухоли в среднем в 1,5 раза снижалась по мере увеличения риска прогрессирования РМЖ, достигая 55,89 и 55,24% в когортах со средним и высоким риском неблагоприятного развития заболевания соответственно. РМЖ, для которого были характерны отрицательный стероидный статус (ЭР– / ПР–) и HER2–, был верифицирован только у 13,16% пациенток когорты с благоприятным развитием заболевания. По мере увеличения риска прогрессирования РМЖ доля женщин с данной характеристикой рецепторного статуса в среднем двукратно увеличивалась.
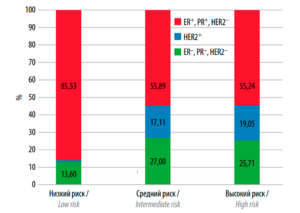
Рис. 2. Распределение пациенток с разным рецепторным статусом в подгруппах низкого, среднего и высокого риска летального исхода по регрессионной шкале. ER – эстрогеновые рецепторы; PR – прогестероновые рецепторы
Группы риска пациенток с ЭР–, ПР–, HER2– статусом представлены на рис. 3. Почти у половины пациенток исследуемой популяции (43,9%) был верифицирован средний риск неблагоприятных событий. Высокий риск прогрессирования РМЖ был верифицирован только у 1/5 (17,3%) обследованных женщин, низкий риск – у 38,8%.
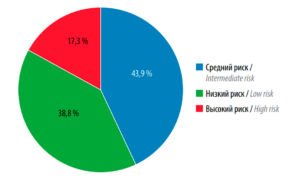
Рис. 3. Деление пациенток группы с ER–, PR–, HER2– статусом по риску, исходя из баллов регрессионной шкалы. ER – эстрогеновые рецепторы; PR – прогестероновые рецепторы
Результаты оценки летальности за 5 и 10 лет в группах различного риска по регрессионной шкале приведены на рис. 4. Летальность в течение 10 лет в группе высокого риска была в 2,5 раза выше таковой в группе низкого риска (25,7% против 10,0%). Согласно представленным результатам статистического анализа, 5-летняя летальность, достигнув максимальных значений в группе высокого риска, составила только 5,8%. Относительно 5-летнего срока наблюдения на временно́м отрезке 10 лет отмечался рост летальности в 3 раза в группе низкого риска и более чем в 4 раза в когорте со средним риском. В когорте с высоким риском неблагоприятного течения заболевания летальность на 10-летнем отрезке времени достигла 30,4%, 5-кратно превысив значения 5-летней летальности. Таким образом, отличия между группами низкого и среднего риска регистрировались при сроке наблюдения 5 и 10 лет.
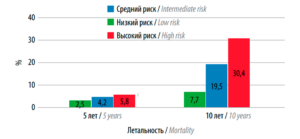
Рис. 4. Летальность в группах низкого, среднего и высокого риска по регрессионной шкале
Анализ выживаемости у пациенток групп высокого и низкого риска по регрессионной шкале продемонстрировал выраженные статистически значимые различия (р < 0,00001) (рис. 5).
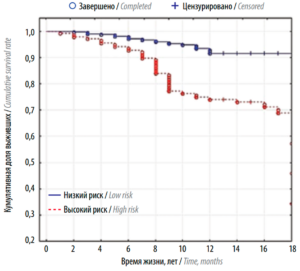
Рис. 5. Кривые Каплана–Майера, отражающие общую выживаемость для групп высокого и низкого риска по регрессионной шкале
Кумулятивные доли выживших на 10-летнем этапе составили 77,3 и 94,0% для групп высокого и низкого риска соответственно. Отношение рисков (hazard ratio) в регрессионной модели Кокса группы высокого риска к группе низкого риска составило 3,29 (95% ДИ 2,01–5,38).
Результаты оценки эффективности адъювантной химиотерапии в объединенной группе среднего и высокого риска летального исхода по регрессионной шкале представлены на рис. 6. Пациентки групп среднего и высокого рисков (от 40 баллов и выше), получающие адъювантную химиотерапию, имели статистически значимые отличия в выживаемости (р = 0,0057).
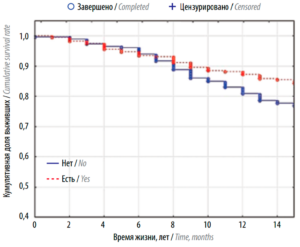
Рис. 6. Кривые Каплана–Майера, отражающие общую выживаемость в зависимости от адъювантной химиотерапии в объединенной группе среднего и высокого риска по регрессионной шкале
Кумулятивные доли выживших на 10-летнем этапе составили 88,6% в группе с химиотерапией и 84,9% в группе без химиотерапии. Отношение рисков в регрессионной модели Кокса группы без химиотерапии к группе с химиотерапией составило 1,53 (95% ДИ 1,12–2,08).
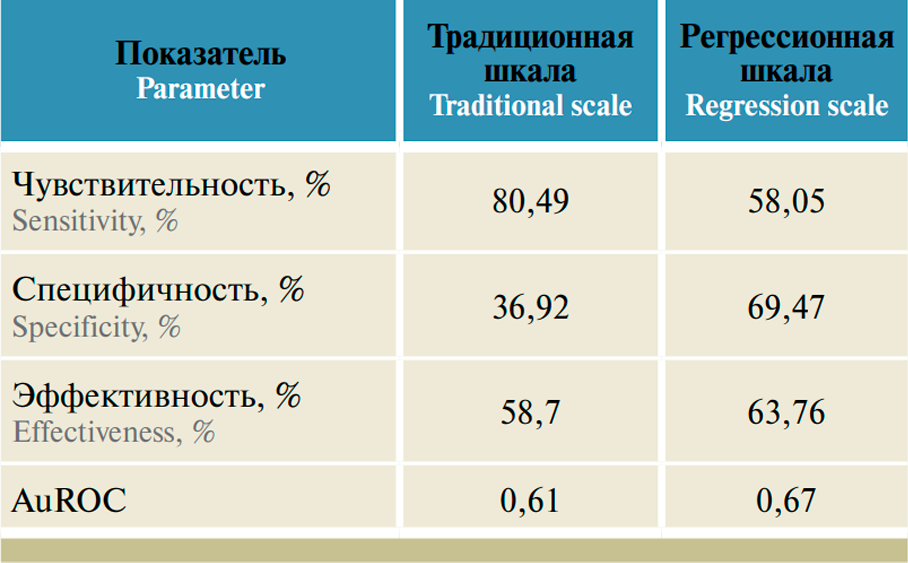
Результаты регрессионной шкалы для показателя летального исхода на 10-летнем этапе продемонстрировали достаточную чувствительность (58,05%), специфичность (69,47%) и эффективность (63,76%) (табл. 7, рис. 7).
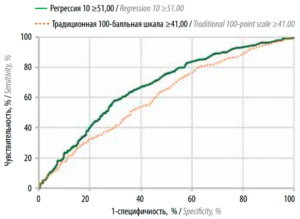
Рис. 7. ROC-кривая для традиционной и регрессионной шкал для 10-летней выживаемости
Таким образом, в основе регрессионной шкалы лежат более точные иммуногистохимические методы оценки.
Заключение
Разработанная регрессионная прогностическая шкала включает как традиционные, так и малоизученные маркеры, для которых была выявлена высокая прогностическая значимость. К последним относится FOXP3 – белок, вовлеченный в иммунные реакции, функционирующий как регулятор (транскрипционный фактор) регуляторных Т-клеток. Прогностическая значимость указанного белка при РМЖ отмечается в ряде исследований [19, 20, 21]. СК14 относится к группе цитокератинов – тканеспецифических белков промежуточных филаментов. E-cadherin – маркер межклеточной адгезии эпителиальных клеток, утрата его экспрессии в раковых клетках является признаком частичной потери эпителиального фенотипа [22, 23]. p53 – транскрипционный фактор, регулирующий клеточный цикл, выполняет функцию супрессора образования злокачественных опухолей [24, 25, 26]. Прогностическая значимость указанных белков при РМЖ отмечается в ряде исследований [27]. Т-лимфоциты CD8 + (цитотоксические) и CD4 + (регуляторные) – одни из ключевых участников клеточного звена иммунитета у больных РМЖ, их прогностическая и предиктивная значимость также установлена целым рядом исследований [20, 21, 28, 29, 30, 31, 32].
Анализ выживаемости у пациенток групп высокого и низкого риска по регрессионной шкале продемонстрировал выраженные статистически значимые различия между группами (р < 0,00001). Кумулятивные доли выживших на 10-летнем этапе составили 77,3 и 94,0% для групп высокого и низкого риска соответственно. Отношение рисков в регрессионной модели Кокса группы высокого риска к группе низкого риска составило 3,29 (95% ДИ 2,01–5,38).
Анализ эффективности адъювантной химиотерапии в объединенной группе среднего и высокого риска летального исхода по регрессионной шкале показал статистически значимое преимущество (р = 0,0057) назначения адъювантной химиотерапии у пациенток групп среднего и высокого риска (от 40 баллов и выше). Кумулятивные доли выживших на 10-летнем этапе составили 88,6% в группе с химиотерапией и 84,9% в группе без химиотерапии. Отношение рисков в регрессионной модели Кокса группы без химиотерапии к группе с химиотерапией составило 1,53 (95% ДИ 1,12–2,08).
Использованный в разработанной регрессионной шкале многофакторный подход к формированию прогноза РМЖ способствует повышению точности и достоверности прогноза.

Таблица 1. Возраст больных и клинико-морфологические характеристики опухоли у пациенток исследуемой популяции (n = 1216)
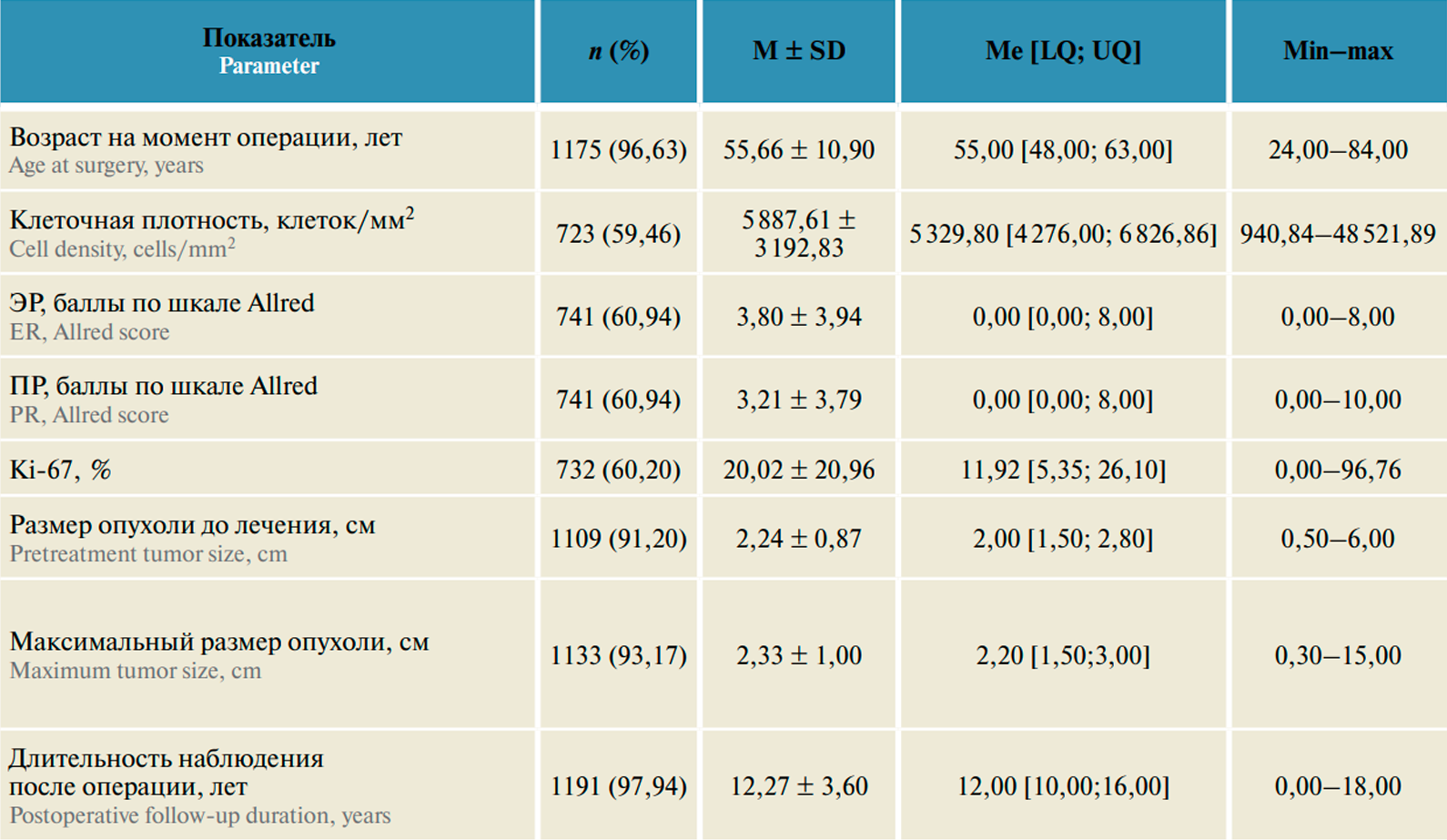
Таблица 2. Методы иммуногистохимических исследований образцов ткани опухоли
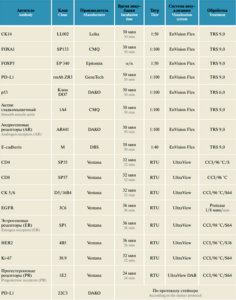
Таблица 3. Распределение маркеров CK14, FOXA1, FOXP3, PD-L1, P53, SMA, AR, E-cadherin, CD4, CD8, CK5/6, EGFR в возрастных группах <50 лет и ≥50 лет
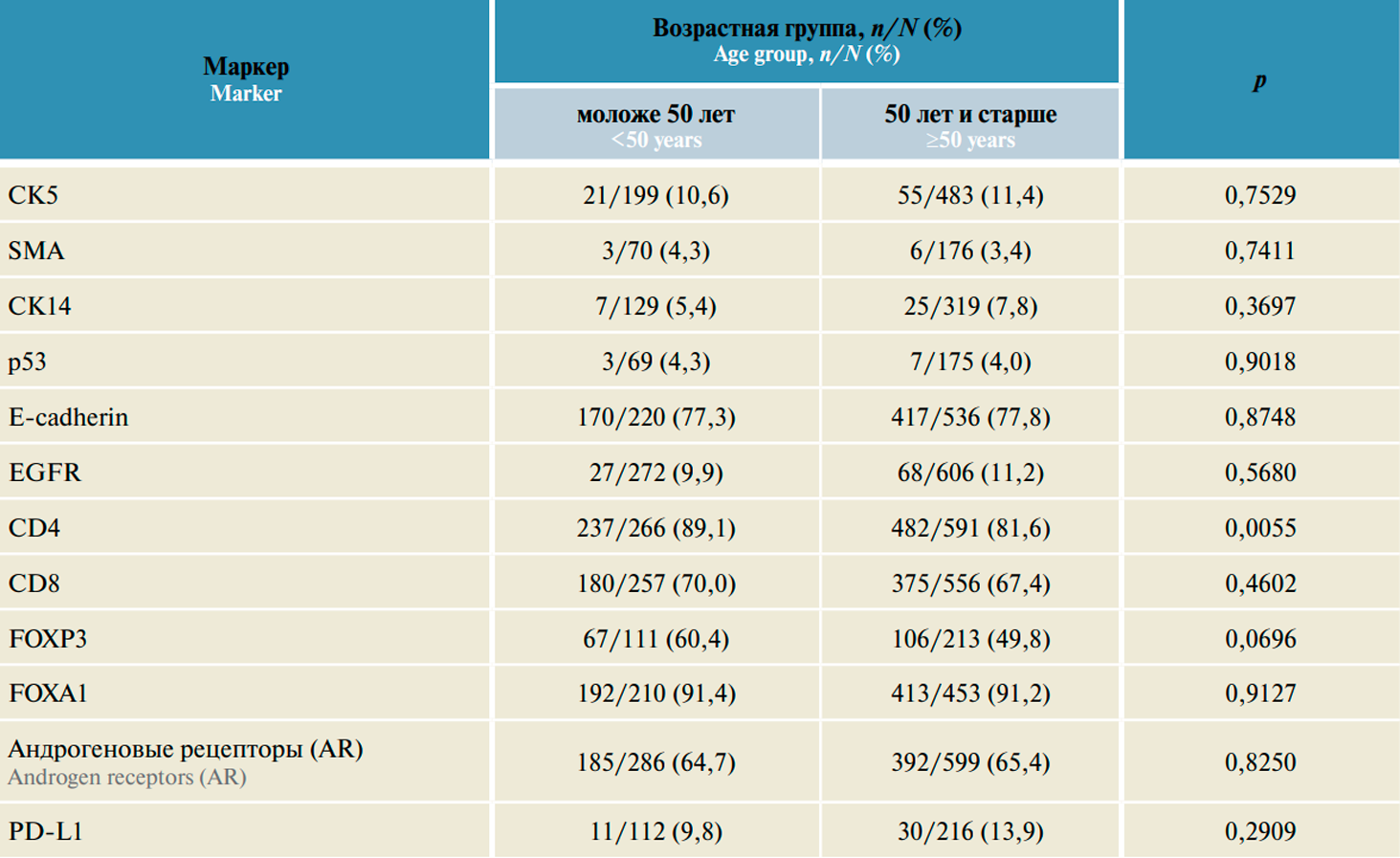
Примечание. n – число пациенток в соответствующей категории; N – число пациенток с имеющимися данными по параметру.
Таблица 4. Результаты пошаговой логистической регрессии для прогнозирования показателя «летальный исход»
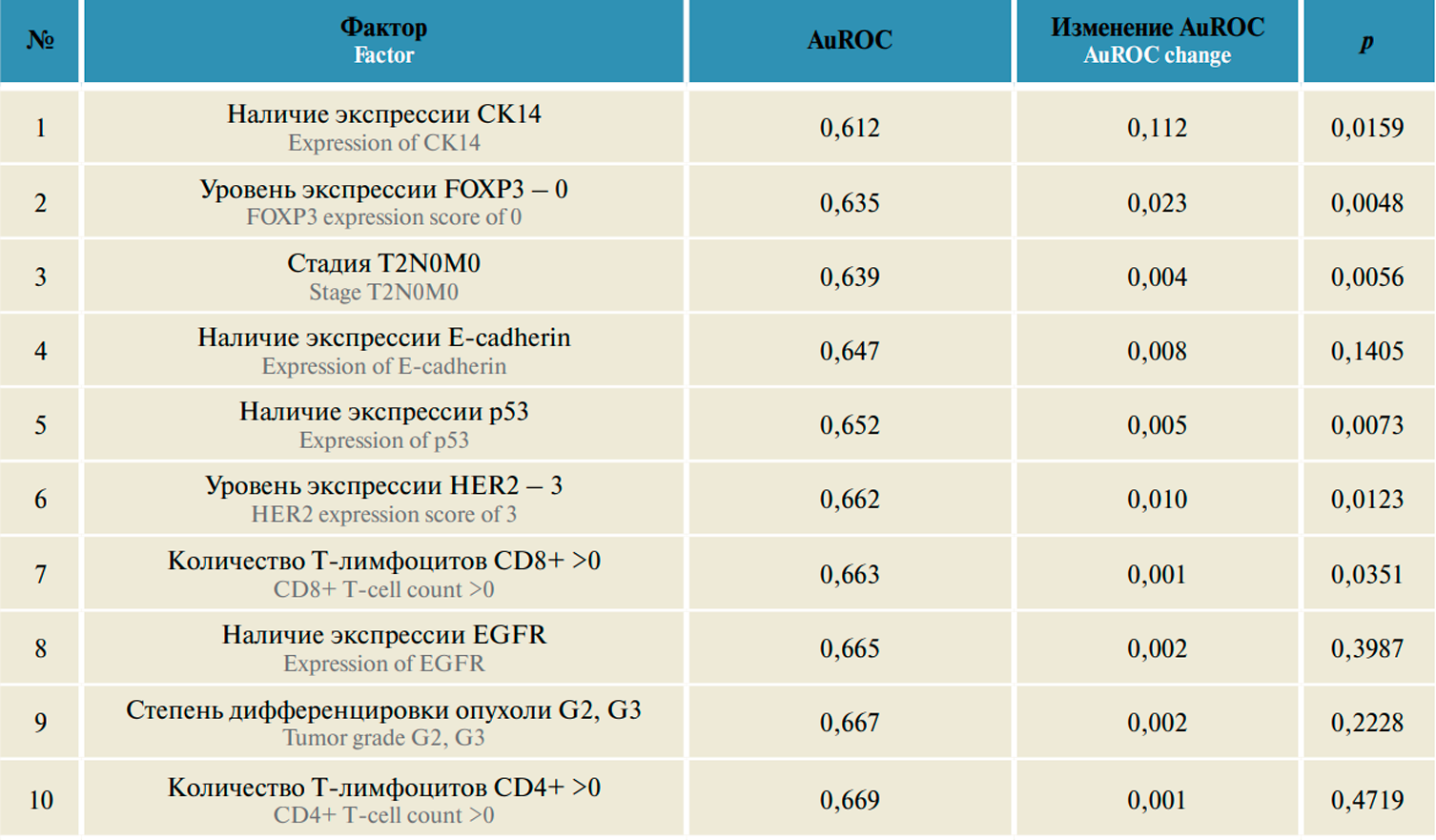
Таблица 5. Результаты сравнения балльных шкал для прогноза показателя «летальный исход»
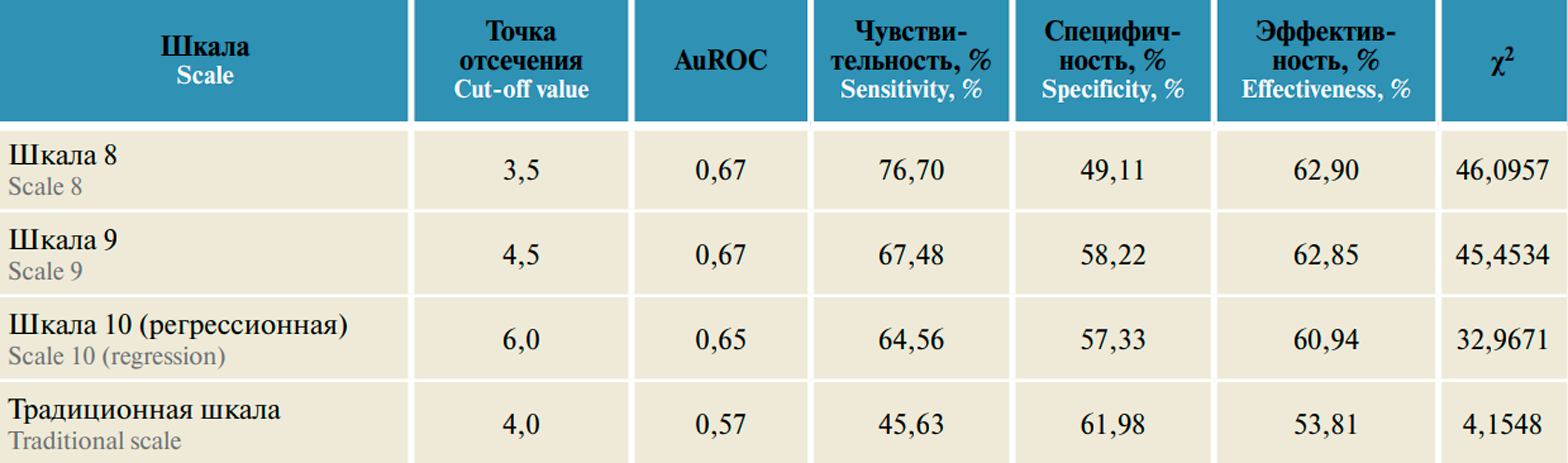
Примечание. Шкала 8: наличие экспрессии СК14, E-cadherin, p53, EGFR; уровень экспрессии FOXP3 – 0, HER2 – 3; T2N0M0; CD8 >0 (8 факторов).
Шкала 9: наличие экспрессии СК14, E-cadherin, p53, EGFR; уровень экспрессии FOXP3 – 0, HER2 – 3; T2N0M0; CD8 >0; степень дифференцировки – G2, G3 (9 факторов).
Шкала 10: наличие экспрессии СК14, E-cadherin, p53, EGFR; уровень экспрессии FOXP3 – 0, HER2 – 3; T2N0M0; CD8 >0; степень дифференцировки – G2, G3; CD4 >0 (10 факторов).
Традиционная шкала: T2N0M0; экспрессия прогестероновых рецепторов <8, эстрогеновых рецепторов <8; G2, G3; HER2 – 3; Ki-67 >5 % (6 факторов).
Палтуев Р.М., Кудайбергенова А.Г., Семиглазов В.Ф. и др. Способ многофакторного прогноза рака молочной железы. Патент на изобретение No RU 2763839 C1 от 11.01.2022 (заявка №2021112377 от 27.04.2021).
Таблица 6. Прогностическая шкала альтернативных маркеров рака молочной железы
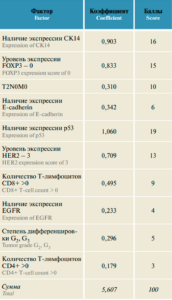
Таблица 7. Результаты сравнения традиционной и регрессионной шкал для показателя «летальный исход» на 10–летнем этапе