
Сохранение фертильности как у женщин, так и у мужчин онкологического профиля в настоящее время возможно и должно быть интегрировано на всех уровнях оказания медицинской помощи. В этой связи целью данного обзора стало отражение темы фертильности лиц мужского пола, подвергшихся лечению по поводу онкологического заболевания, во всех аспектах жизни.
Введение
Показатели выживаемости онкологических пациентов продолжают неуклонно расти благодаря повышению эффективности проводимых методов лечения. Однако, несмотря на достижение значительных онкологических результатов, не стоит забывать и о качестве жизни данной когорты пациентов, в частности тех, кто подвергается гонадотоксической терапии рака с развитием преждевременной недостаточности яичников у женщин и азооспермии у мужчин. Сохранение фертильности как у женщин, так и у мужчин онкологического профиля в настоящее время возможно и должно быть интегрировано на всех уровнях оказания медицинской помощи.
Любое современное общество признает здоровье человека главной ценностью как для государства, так и для личности. Следует отметить, что субъективно правосознание граждан эпохи Советского Союза было намного выше, чем сегодня. Статья 3 Основ законодательства СССР гласила, что граждане имеют право на охрану здоровья. Это право обеспечивается бесплатной квалифицированной медицинской помощью, оказываемой государственными учреждениями здравоохранения; расширением сети учреждений для лечения и укрепления здоровья граждан; развитием и совершенствованием техники безопасности и производственной санитарии; проведением широких профилактических мероприятий; мерами по оздоровлению окружающей среды; особой заботой о здоровье подрастающего поколения, включая запрещение детского труда, не связанного с обучением и трудовым воспитанием; развертыванием научных исследований, направленных на предупреждение и снижение заболеваемости, на обеспечение долголетней активной жизни граждан [1].
Забота о здоровье – социальная установка вести себя определенным образом по отношению к собственному здоровью, ориентируясь на контекст. Такую установку еще называют аттитюдом. Аттитюд предполагает 3 компонента: осознанное мнение, эмоциональное отношение и поведение. Например, человек имеет позитивный аттитюд по отношению к вакцинации. Это значит, что у него есть накопленные знания о ценности вакцин и он, скорее всего, испытает радость, узнав об изобретении важной вакцины, и при благоприятном стечении обстоятельств постарается провести вакцинацию в положенное время. Забота о здоровье предполагает внимание к здоровью (человек должен быть озабочен собственным здоровьем, обращать внимание на свое психическое, социальное и физическое состояние, формировать мнение по поводу него), понимание здоровья как ценности (человек должен испытывать положительные эмоции, повышая качество своего здоровья и расширяя свои возможности, а не просто избавляясь от конкретных заболеваний), формирование правильного образа жизни (человек должен придерживаться практик, распределенных во времени, направленных на укрепление здоровья). Здоровье – это точка приложения усилий, оно не может сформироваться сию секунду, это ресурс, который стоит накапливать.
Сегодня данные нормы пережили колоссальную трансформацию и нашли свое отражение в Федеральном законе от 21.11.2011 №323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации». Статья 27 этого закона, в свою очередь, гласит:
- Граждане обязаны заботиться о сохранении своего здоровья (забота о здоровье становится обязанностью гражданина и требует определенных действий от личности).
- Граждане в случаях, предусмотренных законодательством Российской Федерации, обязаны проходить медицинские осмотры, а граждане, страдающие заболеваниями, представляющими опасность для окружающих, в случаях, предусмотренных законодательством Российской Федерации, обязаны проходить медицинское обследование и лечение, а также заниматься профилактикой этих заболеваний.
- Граждане, находящиеся на лечении, обязаны соблюдать режим лечения, в том числе определенный на период их временной нетрудоспособности, и правила поведения пациента в медицинских организациях.
Именно непонимание и несоблюдение этих норм делает медицинский персонал особо уязвимым. Низкий уровень правосознания и пренебрежительное отношение к здоровью трансформируются в перекладывание ответственности с себя на работников практического звена здравоохранения, что подтверждается сегодня огромным количеством административных и уголовных дел по отношению к медицинскому персоналу в России. При описании заботы о здоровье стоит упомянуть концепт «локус контроля». Забота о здоровье ориентируется на внутренний локус контроля, когда человек понимает, что сам отвечает за свое тело и здоровье в соответствии с контекстом и различными ситуациями. Зачастую врачи проделывают огромную работу по сбору информации, изучению болезней и синтезу методик по профилактике и лечению различных заболеваний, но все это может обернуться провалом, если пациент пренебрежительно относится к своему здоровью.
Одним из таких аспектов является проблема сохранения фертильности у пациентов с герминогенными опухолями яичка (ГОЯ), бо́льшая часть которых достаточно молоды и не реализованы репродуктивно.
По оценкам специалистов, около 15–20% пар во всем мире не могут зачать ребенка после 12 мес. регулярных половых актов [2, 3]. Одной из причин этого является мужское бесплодие. Опубликованные обзоры литературы имеют ограниченные сведения о распространенности мужского бесплодия в мире, поскольку в ряде стран установленные этнические и культурные традиции могут препятствовать сбору и получению точных статистических данных. Кроме этого, в настоящее время полигамия зачастую считается не только формой брачного союза между мужчиной и женщиной, но и в ряде некоторых стран нередко расценивается как возможность преодоления бесплодия путем увеличения вероятности рождения ребенка. Также множество исследований, посвященных изучению мужской инфертильности, представлены только мужчинами, обратившимися за медицинской помощью по лечению бесплодия, данные когорты пациентов не являются репрезентативными для большей части бесплодных мужчин. Это приводит к занижению данных о распространенности мужского бесплодия и сохранению маскулинной идентичности мужчины в глазах общества [4].
Поэтому мужское бесплодие следует отнести к глобальной и злободневной проблеме, требующей незамедлительных действий со стороны не только медицинских работников, но и общества в целом.
С 1 января 2021 года действует обновленный Приказ Минздрава Российской Федерации от 31.07.2020 №803н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению», согласно которому в целях сохранения фертильности пациентам онкологического профиля перед химио- и лучевой терапией показана криоконсервация биоматериалов [5]. Консультирование пациента врачом-онкологом включает обследование, гистологическую верификацию диагноза, интерпретацию визуальных методов исследования, что позволяет установить степень распространения опухолевого процесса, составить мнение о прогнозе заболевания, поставить клинический диагноз, а также провести оценку гонадотоксичности планируемой специализированной терапии, степени заинтересованности в реализации репродуктивной функции и определить необходимость направления к репродуктологу. Консультирование пациента репродуктологом включает оценку репродуктивного потенциала, предоставление информации о возможных вариантах сохранения фертильности, составление и реализацию индивидуальной программы сохранения фертильности без отрицательного влияния на злокачественный процесс и с учетом безопасной отсрочки старта специализированной терапии. Значимым фактом является не только сохранение биологического материала в целях реализации репродуктивной функции после лечения, но и обеспечение быстрого начала онкологической терапии, коррекция побочных эффектов, в том числе половой дисфункции, своевременное назначение контрацепции. В этом аспекте консультирование репродуктологом приобретает более широкое значение и должно также проводиться параллельно динамическому наблюдению после окончания онкологической терапии, если пациент в данный момент не желает заводить детей. Предоставление информации онкологическим пациентам репродуктивного возраста о возможности реализации своих прав по сохранению фертильности должно стать обязательным, подразумевая высокую приверженность к радикальному лечению и возможность иметь семью в будущем, нивелируя потенциально большое количество побочных эффектов от проводимой терапии [6].
Оценка мужского здоровья состоит в определении потенциально обратимых эффектов гонадотоксичной терапии, поддающихся коррекции вспомогательными репродуктивными технологиями (ВРТ), необратимых эффектов (возможна донорская инсеминация спермы для зачатия), опасных для жизни или здоровья состояний, которые могут лежать в основе бесплодия и требуют медицинской помощи и наличия генетических аномалий, способных повлиять на здоровье ребенка, если будут использоваться ВРТ.
Кроме того, выявление генетических причин мужского бесплодия позволит парам быть информированными о возможности передачи генетических аномалий их детям. Также необходимо помнить, что мужское бесплодие может быть проявлением потенциально опасного для жизни заболевания, такого как ГОЯ, несвоевременная диагностика которой может иметь серьезные последствия, вплоть до летального исхода [7].
Связь риска бесплодия с герминогенной опухолью яичка
Варикоцеле встречается примерно у 15% всего мужского населения и в анамнезе у 40% бесплодных мужчин. В 85% случаев варикоцеле бывает левосторонним, в 15% – двусторонним либо правосторонним [8, 9]. Однако в ретроспективном исследовании с участием более 4000 мужчин с варикоцеле (в 8% случаев правосторонним) продемонстрировано отсутствие различий в диагностике ГОЯ на основе латеральности варикоцеле (р = 0,313). При этом рак был диагностирован у 2,67% пациентов с правосторонним варикоцеле, у 1,63% – с левосторонним и у 2,15% – с двусторонним [10]. В крупнейшем из последних метаанализов J. Wang и соавт. продемонстрировали более высокие показатели беременности у женщин, чьи мужчины получили своевременное лечение варикоцеле, по сравнению с теми, у кого отсутствовало лечение. Частота беременности у женщин, чьи мужчины не получали лечения, составила 17%, а в паре, в которой мужчина перенес субингвинальную микрохирургическую варикоцелэктомию, – 42% (95% доверительный интервал (ДИ) 26–61%), паховую варикоцелэктомию – 37% (95% ДИ 22–58%), паховую микрохирургическую варикоцелэктомию – 35% (95% ДИ 21–54%). Однако подобные данные следует интерпретировать с осторожностью, поскольку метаанализ включал исследования с нерандомизированным дизайном и выборочной отчетностью о результатах [11].
Аномалии яичек, такие как крипторхизм, повышают риск развития бесплодия. Около 10% мужчин с признаками инфертильности имеют в анамнезе неопущение яичка и орхидопексию, 20–27% – азооспермию и 3–8% – олиготератоастеноспермию; в данной когорте относительный риск развития злокачественных новообразований яичка в 4–9 раз больше, чем в популяции здоровых мужчин [12]. У новорожденных частота развития крипторхизма составляет 2,4–5%, причем чаще наблюдается у недоношенных детей [13, 14].
В некоторых исследованиях продемонстрирована прямая корреляционная связь длительности крипторхизма с риском развития тестикулярного рака. Шведская группа исследователей под руководством A. Pettersson провела когортное исследование с участием 16 983 мужчин, которые были подвергнуты хирургическому лечению крипторхизма. Выявлено 56 случаев рака яичка за период наблюдения. Относительный риск рака яичка у тех, кто перенес орхиопексию до достижения 13-летнего возраста, составил 2,23 (95% ДИ 1,58–3,06), у тех, кто лечился в возрасте 13 лет и старше, – 5,40 (95% ДИ 3,20–8,53). Однако в ряде некоторых работ не удалось найти корреляции времени операции с риском развития ГОЯ [15, 16].
Несмотря на улучшение показателей фертильности у взрослых мужчин, перенесших хирургическую коррекцию крипторхизма в младенчестве, бесплодие остается нерешенной проблемой. После операции 80% мужчин с двусторонним крипторхизмом в анамнезе и 30% мужчин с односторонним крипторхизмом имеют аномальное количество сперматозоидов [17]. При этом количество исследований, посвященных изучению механизмов развития ГОЯ у пациентов с крипторхизмом, ограниченно. Представлены теории о нарушении процессов дифференцировки сперматогониев, выключении сигнальных путей, накоплении дополнительных мутаций, что приводит к смещению от сперматогенеза к преднеопластическим состояниям [18].
Стоит отметить, что по мере увеличения количества исследований, посвященных изучению бесплодия, стало появляться больше работ, в которых подтверждается развитие бесплодия как раннего предиктора злокачественности. Взаимосвязь между мужским бесплодием и ГОЯ является многофакторной и представлена сочетанием гормональных нарушений в процессе эмбриогенеза, сбоем модуляции первичных зародышевых клеток, дифференцировкой мезенхимальных клеток и клеток Сертоли, что приводит к нарушению стероидогенеза и сперматогенеза, создавая в совокупности предрасположенность к бесплодию и тестикулярному раку [19].
J.D. Raman и соавт. провели ретроспективное исследование с участием 3800 мужчин, получивших лечение по поводу бесплодия. У 10 пациентов в спермограмме была выявлена олигоспермия или азооспермия тяжелой степени с сопутствующими дефектами подвижности или морфологии сперматозоидов и диагностирована ГОЯ по данным контрольных обследований. Анализ баз данных показал, что заболеваемость ГОЯ у пациентов всех возрастов и рас составляет 5,1 на 100 тыс. мужского населения. В исследуемой группе частота рака яичка составила 10,6 на 100 тыс. мужского населения [20].
В крупном датском когортном исследовании, включившем 32 442 мужчины, сдавших спермограмму в период с 1963 по 1995 год, продемонстрировано, что среди мужчин, имевших аномалии спермы, был увеличен риск развития ГОЯ по сравнению с населением Дании в целом (стандартизованное отношение заболеваемости (standardi- zed incidence ratio (SIR)) 1,6; 95% ДИ 1,3–1,9) [21].
В когортном ретроспективном исследовании, проведенном T.J. Walsh и соавт., у 22 562 пар, у которых был подтвержден мужской фактор бесплодия, риск развития рака яичка у мужчин сравнивали с таковым у мужчин в общей популяции без данного фактора. Многопараметрический анализ заболеваемости раком яичка показал более высокий риск развития рака яичка у мужчин с бесплодием (SIR 2,8; 95% ДИ 1,5–4,8) [22].
В ретроспективном когортном исследовании штата Юта с участием 20 433 мужчин получен повышенный риск развития рака яичка у лиц с олигозооспермией по данным спермограммы (относительный риск 11,9). Также было обнаружено, что мужчины с самым низким квартилем по уровню подвижности, жизнеспособности, морфологии или общего количества подвижных форм сперматозоидов имеют более высокий риск развития рака яичка [23].
Связь мужского бесплодия с ГОЯ подчеркивается и в других исследованиях, показавших, что братья мужчин с диагнозом рака яичка также могут иметь сниженную фертильность и повышенный риск развития ГОЯ [24].
Статистически подтвержденная ассоциация мужской инфертильности с раком яичка неудивительна, поскольку сперматогенез и опухолевый процесс являются одними из самых высокопроизводительных в организме человека. Несмотря на то что частота встречаемости ГОЯ составляет всего 1%, это наиболее распространенный вид рака, диагностируемый у лиц мужского пола в возрасте 15–35 лет [25].
В России за последние 10 лет не отмечено существенного роста частоты выявления ГОЯ. В 2019 году было диагностировано 1540 новых случаев ГОЯ [26]. Несмотря на агрессивное течение заболевания, при своевременной комбинированной терапии 5-летняя выживаемость без прогрессирования и 5-летняя общая выживаемость пациентов группы благоприятного и промежуточного прогноза приближаются к 90%, а группы неблагоприятного прогноза – к 70% [27, 28]. Таким образом, возраст манифестации заболевания совпадает с пиком репродуктивного возраста мужчин, желающих реализовать репродуктивную функцию. Длительные выживаемость без прогрессирования и общая выживаемость обусловливают необходимость своевременного использования репродуктивных технологий, что позволит приблизить качество жизни таких пациентов после проведенного лечения к уровню до развития заболевания.
Значимость использования репродуктивных технологий подчеркивает тот факт, что особое беспокойство у молодых мужчин вызывает сохранение возможности репродуктивной способности после проведенного лечения [29]. С учетом улучшения онкологических показателей за последние десятилетия основным вектором исследований становится рассмотрение физических и психологических особенностей пациентов [30]. Потеря фертильности является разрушительным эмоциональным воздействием для молодых лиц, борющихся с онкологическим заболеванием [31, 32, 33]. Цитостатические противоопухолевые препараты кроме ингибирования роста опухолевых клеток приводят к нарушению дифференцировки и пролиферации всех быстроделящихся клеток организма, в том числе участвующих в сперматогенезе [34]. Несмотря на то что риск развития бесплодия, связанного с проводимым онкологическим лечением, зависит от множества факторов, таких как режим химиотерапии, возраст пациента, сопутствующие заболевания, наибольший гонадотоксичный эффект оказывают химио- и лучевая терапия.
Тем не менее в ряде исследований показано, что предоставление информации о возможных проблемах фертильности воспринимается пациентами неверно и врачи-онкологи не обладают достаточными знаниями о рисках нарушения фертильности и вариантах ее сохранения [35]. В результате информация предоставляется несвоевременно или не предоставляется вообще [36, 37, 38]. Во время постановки онкологического диагноза зачастую вопросы фертильности опускаются из обсуждения, перевешиваются вниманием к излечению и выживанию. Тем не менее в нескольких исследованиях продемонстрирован повышенный психологический стресс, обусловленный утраченной фертильностью, у пациентов, находящихся под динамическим наблюдением после комбинированного лечения по поводу ГОЯ. Это объясняет, что консультация репродуктолога по сохранению фертильности до начала лечения по сравнению с консультацией только врача-онколога связана с лучшим психологическим здоровьем пациентов [39]. В Нидерландах среди медицинского общества онкологов был проведен опрос об информированности сохранения фертильности у онкологических пациентов репродуктивного возраста. Из 392 участников анкету заполнили 120 (30,6%). Большинство (93,2%) онкологов были убеждены, что обсуждение влияния лечения рака на фертильность является их обязанностью, но 68,3% врачей обсуждали эту тему лишь частично. При этом врачи-онкологи, работающие в больницах общего профиля, реже обсуждали вопросы сохранения фертильности (р = 0,033). В целом результаты демонстрируют ответственность врачей-онкологов в вопросах сохранения фертильности онкологических больных, однако самооценка знаний сильно различается, и большинство респондентов выразили желание получить дополнительное образование по данным вопросам [40]. Таким образом, недостаточная осведомленность врачей-онкологов в вопросах консультирования мужчин по сохранению фертильности до начала специализированного лечения является частой причиной потери репродуктивного здоровья.
С учетом того что пациенты с ГОЯ в абсолютном большинстве находятся в репродуктивном возрасте, своевременная прогностическая оценка и сохранение их фертильности могут стать единственным шансом деторождения после успешного завершения комбинированного лечения. Необходимо помнить, что ГОЯ являются наиболее распространенным онкологическим заболеванием среди мужчин репродуктивного возраста, но с хорошими показателями общей выживаемости и выживаемости без прогрессирования, поэтому у данных пациентов необходимо оценить фертильность до начала специализированной терапии в целях возможности выполнить репродуктивную функцию. Текущие клинические руководства рекомендуют направлять пациентов с впервые выявленной опухолью яичка, включая тех, у кого уже есть дети, на консультацию к репродуктологу для обсуждения фертильности в рамках комплексной онкологической помощи [41, 42, 43, 44].
Хирургическое лечение
«Золотым стандартом» первого этапа лечения пациентов с ГОЯ является орхфуникулэктомия, позволяющая получить гистологическую верификацию заболевания и удалить первичную опухоль. При наличии диссеминированного метастатического процесса и угрожающих жизни метастазов лечение следует начинать с химиотерапии, отложив проведение орхфуникулэктомии до стабилизации состояния пациента [45].
В последнее время появляется все больше публикаций, посвященных вопросам проведения органосохраняющих операций у пациентов с ГОЯ в целях сохранения эндо- и экзокринной функции яичка и тем самым возможности реализовать репродуктивную функцию. Этому способствовали исследования, проведенные в 1986 году, когда впервые была описана высокая частота выявления доброкачественных образований яичка – 31% из 233 пациентов с подозрением на ГОЯ, 70% из которых подверглись орхфуникулэктомии [46]. Также доступность и совершенствование методов визуализации увеличили верификацию небольших гистологически доброкачественных и медленно растущих образований яичка [47]. Частота данных непальпируемых (размером 10–15 мм) образований достигает 7,4% [48]. Тем не менее исследования с высоким уровнем доказательности, посвященные сравнению онкологических результатов органосохраняющих операций и радикальной орхфуникулэктомии, отсутствуют. Необходимы дальнейшие проспективные исследования в целях определения показаний для отбора пациентов для органосохраняющего лечения злокачественных новообразований яичек.
Клинический случай 1
Пациент К., 30 лет, в марте 2014 года самостоятельно обратился к онкологу в клинико-диагностическое отделение НМИЦ онкологии им. Н.Н. Петрова. Из анамнеза известно, что при профилактическом обследовании пациенту была проведена ультрасонография мошонки, при которой выявлено гипоэхогенное образование правого яичка размером 10 × 12 мм, неоднородной структуры, с четким ровным контуром (рис. 1).
При дополнительном обследовании в НМИЦ онкологии им. Н.Н. Петрова (компьютерной томографии (КТ) органов грудной, брюшной полости и малого таза) патологии не выявлено. Результат магнитно-резонансной томографии мошонки: яички обычно расположены, симметричны, структура яичек и их придатков гомогенная; размер правого яичка 37 × 32 × 22 мм (объем 13,5 см3), левого – 27 × 24 × 33 мм (объем 11,1 см3); белочная оболочка визуализируется отчетливо, не утолщена; накопление контрастного препарата однородное; отмечается умеренное расширение вен лозовидного сплетения слева; данных о наличии опухоли не получено.
Оценен фертильный статус пациента: анализы крови на лютеинизирующий гормон (ЛГ), фолликулостимулирующий гормон (ФСГ), тестостерон, онкомаркеры (α-фетопротеин, лактатдегидрогеназу, β-хорионический гонадотропин человека) в пределах нормы. В спермограмме – нормоспермия.
С учетом непальпируемого асимптомного образования правого яичка пациенту предложена резекция яичка под ультразвуковой навигацией и с использованием операционного микроскопа (×1,6). При срочном гистологическом исследовании выявлены клетки, подозрительные на семиному. В связи с этим принято решение о выполнении радикальной орхфуникулэктомии. Гистологическое заключение операционного материала: фокус семиномы, 4 мм в наибольшем измерении, на фоне семиномы in situ. Пациенту установлен диагноз: герминогенная семиномная опухоль правого яичка рТ1N0M0, S0, стадия Ia, группа благоприятного прогноза по классификации Международной объединенной группы по герминогенным опухолям (International Germ Cell Consensus Classification Group, IGCCCG).
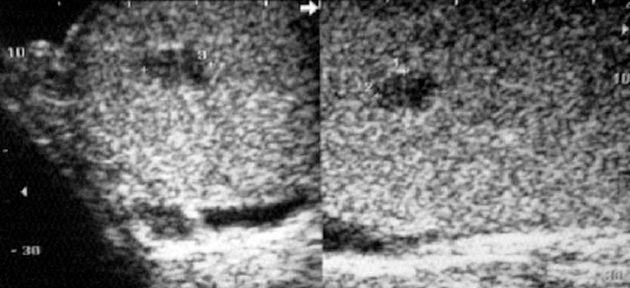
Рис. 1. Ультразвуковое исследование мошонки: образование правого яичка размером 10 × 12 мм
Проведен 1 курс адъювантной химиотерапии карбоплатином AUC7. В настоящее время (при контрольном обследовании в марте 2022 года) клинико-инструментальных данных о наличии рецидива опухоли не выявлено. При оценке фертильного статуса анализы крови на ЛГ, ФСГ, тестостерон, показатели спермограммы в пределах нормы.
У супруги пациента наступила беременность через 8 мес. после проведенного лечения. В настоящее время родились 3 детей после лечения.
Важное значение имеют соблюдение онкологических принципов лечения, динамического наблюдения и соответствующий отбор пациентов. Таким образом, у тщательно отобранных пациентов и в опытных руках резекция яичка – перспективный метод сохранения функциональной ткани яичек и потенциальной фертильности.
Клинический случай 2
Пациент С., 30 лет, в июле 2018 года обратился к урологу-андрологу по поводу бесплодия. При ультразвуковом исследовании мошонки выявлено гипоэхогенное неоднородное образование яичка размером 26 × 16 мм, с четким ровным контуром. Пациент направлен в НМИЦ онкологии им. Н.Н. Петрова.
При КТ органов грудной, брюшной полости и малого таза патологии не выявлено. Результат магнитно-резонансной томографии мошонки: правое яичко размером 45 × 33 × 35 мм (объем 27 см3), неоднородной структуры за счет наличия в средней трети образования общим размером 25 × 30 мм, с четким неровным контуром, характеризующегося гипоинтенсивным магнитно-резонансным сигналом на Т2-взвешенном изображении (с гиперинтенсивными включениями в центральных отделах), изоинтенсивным магнитно-резонансным сигналом на Т1-взвешенном изображении, активным неоднородным накоплением контрастного препарата на постконтрастных изображениях.
Пациенту были рекомендованы оперативное лечение в объеме орхфуникулэктомии, а также консультация репродуктолога, от которых пациент отказался без объяснения причин.
В июне 2021 года пациент повторно обратился в НМИЦ онкологии им. Н.Н. Петрова с жалобами на увеличение яичка до 35 × 30 × 28 см (масса 9856 г). При КТ отдаленных метастазов не выявлено. Уровень онкомаркеров в пределах референсных значений. Анализы на ЛГ, ФСГ, тестостерон в пределах нормы. В спермограмме – астенотератозооспермия.
Пациенту была выполнена орхфуникулэктомия. От дальнейшего лечения и наблюдения пациент отказался. По телефону сообщил об отсутствии беременности у супруги.
Химиотерапия
В литературе достаточно хорошо освещены вопросы о режимах химиотерапии и их воздействии на мужскую фертильность. M. Ghezzi и соавт. оценили влияние химиотерапии на репродуктивную функцию после орхфуникулэктомии, сравнили лечение карбоплатином в монорежиме с терапией по схеме BEP (блеомицин, этопозид, цисплатин). В группу сравнения вошли пациенты без химиотерапии, которым после хирургического лечения выполнялось динамическое наблюдение. Оценивались общие параметры сперматогенеза, анеуплоидия сперматозоидов и фрагментация ДНК. В исследовании 212 пациентов наблюдали в 12- и 24-месячный интервальный период. Через 24 мес. после окончания химиотерапии по схеме BEP были отмечены увеличение частоты анеуплоидии сперматозоидов, сохранение фрагментации ДНК. При этом 1 цикл карбоплатином в монорежиме не влиял на показатели анеуплоидии и фрагментации ДНК сперматозоидов [49].
В одном исследовании выявлено увеличение повреждения ДНК, которое сохранялось через 6–24 мес. после окончания комбинированного лечения [50], в другом исследовании, наоборот, не обнаружено увеличения повреждения ДНК [51].
Лучевая терапия
Отрицательное воздействие на сперматогенез происходит при очаговой дозе 0,1–1,2 Гр, необратимое повреждение гонад – при дозе 4 Гр [52]. Доза облучения < 0,8 Гр может привести к олигоспермии, доза > 0,8 Гр – к азооспермии. Тем не менее совершенствование технического оснащения, прицельное планирование и защита половых желез позволяют в некоторых случаях восстановить сперматогенез через 9–18 мес. после лучевой терапии в очаговой дозе 1 Гр, через 30 мес. при очаговой дозе до 2–3 Гр и через 5 лет при очаговой дозе до 4 Гр [53].
Стратегия сохранения фертильности мужчин с онкологическим диагнозом
Несмотря на высокие риски потери фертильности вследствие проводимого лечения, в ряде исследований число пациентов, выполнивших криоконсервацию спермы, было существенно ниже, чем можно было ожидать. Так, в исследовании L.R. Schover и соавт. 91% респондентов согласились с необходимостью предлагать криоконсервацию спермы всем пациентам, подверженным риску бесплодия в результате лечения рака. Однако 48% из них либо никогда не информировали об этом пациента, либо упоминали об этом лишь в 1/4 всех случаев. Ни более глубокие знания о криоконсервации спермы, ни ежегодное наблюдение за большим числом пациентов с высоким риском потери фертильности не повысили вероятность обсуждения этого вопроса. Основными препятствиями для обсуждения данного вопроса являлись нехватка времени, кажущаяся высокая стоимость и отсутствие необходимых условий [54]. Так, в исследовании с участием более 800 пациентов в возрасте 14–30 лет с впервые выявленными ГОЯ только 18% мужчин выполнили криоконсервацию спермы [55]. В исследовании D.W. Sonnenburg и соавт. было проведено анкетирование 200 пациентов с ГОЯ, 139 (70%) из них отказались от криоконсервации спермы: 18% – вследствие желания безотлагательно начать системную терапию, 9% – из-за стоимости, 51% пациентов не интересовались данным вопросом, 24 (17%) пациента указали на отсутствие информированности по этому вопросу со стороны лечащего врача [56]. Эти данные подчеркивают несоответствие между рекомендациями и числом пациентов, которые воспользовались услугами криоконсервации спермы.
Метаанализ B. Gerstl и соавт. показал, что уровень зачатия у пар после лечения ГОЯ составил 22%, при этом более половины (52,29%) всех пар были заинтересованы в деторождении. Воспользовались услугами ВРТ для зачатия (интрацитоплазматическая инъекция сперматозоидов (IntraCytoplasmic Sperm Injection, ICSI) – экстракорпоральное оплодотворение (ЭКО) или внутриматочная инсеминация) 31,8% пар. Большинство пар имели менее 25 (19–23) % шансов зачать ребенка с партнером после лечения ГОЯ в объеме орхфуникулэктомии с химиотерапией, лучевой терапией, забрюшинной лимфаденэктомией или без них. Среди пар, которым удалось зачать ребенка, менее чем у половины (37%) родились живые дети [57].
Однако, по данным литературы, бесплодие возникает только у 25% пациентов после комбинированного лечения рака яичка в течение первых 2–5 лет [58]. В исследовании A. Syse и соавт. мужчины после терапии по поводу рака яичка имели на 24% меньший шанс завести первого ребенка по сравнению с мужским населением в целом при сопоставлении по возрасту и образованию [59]. Аналогичные результаты были получены D.M. Green и соавт., в исследовании которых мужчины после терапии рака яичка имели на 44% меньший шанс на зачатие по сравнению с кровными братьями, не получавшими лечение от злокачественного заболевания [31].
С учетом низких показателей рождаемости у пациентов после комбинированного лечения рака яичка по сравнению с мужским населением общей популяции необходимо придерживаться международных принципов и направлять пациентов к репродуктологам для обсуждения связанных с лечением рисков нарушений фертильной функции до начала специализированной терапии. Следует отметить, что у онкологических пациентов развитие бесплодия может быть связано не только со злокачественным процессом, но и с сопутствующей патологией (импотенцией, сахарным диабетом, низкой выработкой спермы, повреждением семявыводящих протоков, причинами, препятствующими доставке спермы). Данная категория пациентов подвержена наибольшему риску развития бесплодия.
Оценку полового созревания следует проводить специалисту, имеющему опыт такой оценки, но ни один клинический параметр не может точно предсказать наличие и качественный состав спермы.
Криоконсервация спермы – легкодоступный вариант сохранения мужской фертильности более чем у 95% пациентов. Существует 2 возможных варианта криоконсервации спермы:
- криоконсервация в виалах объемом до 1–2 мл, если у пациента высокая концентрация сперматозоидов;
- криоконсервация единичных сперматозоидов на индивидуальных носителях при наличии криптозооспермии.
Для пациентов онкологического профиля важно, чтобы криоконсервированный биологический материал был разделен на несколько порций в целях удобного использования при расконсервации и обеспечения нескольких попыток ЭКО. В случае азооспермии, выявленной в день сдачи, должна существовать возможность экстренной консультации андролога с проведением TESA/TESE (testicular sperm aspiration/extraction) – процесса экстракции сперматозоидов непосредственно из ткани семенников путем чрескожной биопсии яичка. После получения биоптата возможна его криоконсервация [60].
Криоконсервация ткани яичка. Представлены работы по криоконсервации тестикулярной ткани, однако эффективность данного метода еще не изучена достаточным образом. В настоящее время данная процедура проводилась на экспериментальных моделях животных и требует дальнейших исследований [61]. Для пациентов, находящихся в предпубертатном возрасте, и в случаях, когда получение образца спермы невозможно, сохранение фертильности должно быть осуществлено с помощью забора биоптата яичка. Для пациентов пубертатного возраста, неспособных получить удовлетворительный образец спермы, должна быть рекомендована биопсия яичек с интраоперационным анализом для получения тканей, содержащих сперматозоиды. Данная манипуляция должна проводиться хирургом, эмбриологом или андрологом с использованием микроскопа и наличием опыта анализа тестикулярной ткани. В случае отсутствия сперматозоидов в образцах или получения сомнительных результатов ткань следует криоконсервировать по протоколу, используемому для пациентов препубертатного возраста.
Культивирование сперматогониальных стволовых клеток (SSC) in vitro. Методы культивирования in vitro для увеличения и очистки SSC гонад направлены на улучшение их дифференцировки в жизнеспособные сперматиды, а затем – на достижение оплодотворения с помощью ICSI. Однако остаются нерешенными вопросы наиболее оптимального метода криоконсервации тестикулярной ткани для сохранения максимальной жизнеспособности клеток и разработки эффективных методов дифференцировки человеческих SSC в сперматиды in vitro с последующим созреванием до зрелой стадии сперматозоида. На сегодняшний день данные методы являются экспериментальными и не получили широкого распространения [62].
Лиофилизация спермы позволяет хранить материал без использования жидкого азота в течение длительного времени. Метод основан на высушивании сперматозоидов под давлением. Основными проблемами являются сохранность ДНК сперматозоидов и отсутствие подвижности после лиофилизации, что создает сложности отбора таких сперматозоидов при ICSI. Кроме того, исследования возможностей лиофилизации спермы человека еще проводятся [63, 64].
Интрацитоплазматическая инъекция сперматозоида (IntraCytoplasmic Sperm Injection, ICSI) представляет собой отбор наилучшего по морфологии сперматозоида с последующей его механической инъекцией в ооцит. Данный метод применяется при тяжелой патоспермии, нарушениях подвижности и сниженной морфологии сперматозоидов.
Intracytoplasmic Morphologically–selected Sperm Injection (IMSI) – метод отбора сперматозоида, у которого отсутствует вакуоль в области ядра головки. Эффективность метода по увеличению процента беременности не доказана.
Physiological IntraCytoplasmic Sperm Injection (PICSI) – метод, основанный на том, что сперматозоиды со зрелой ДНК связываются с гиалуроновой кислотой, которая участвует в связывании сперматозоидов с клетками кумулуса. Гиалуроновая кислота наносится на дно чашки, где сперматозоиды со зрелой ДНК связываются в области нанесения, а сперматозоиды с незрелой ДНК двигаются беспорядочно и связывания не происходит. Далее эмбриолог осуществляет отбор сперматозоидов, связавшихся с подложкой, и проводит ICSI.
На сегодняшний день количество данных о результатах применения ВРТ у пациентов онкологического профиля ограниченно для достоверных выводов. Однако существующие технологии и возможный потенциал требуют проведения дальнейших исследований в этой области, а также их полноценного внедрения для сохранения мужской фертильности.
Методы сохранения фертильности с точки зрения религии
Религиозные взгляды и исходящие из них нравственно-этические нормы являются цивилизационной детерминантой не только для христианского мира, но также и для народов, исповедующих ислам, буддизм, иудаизм или иные, имеющие локальное распространение религиозные направления. Следует отметить, что именно нравственно-этические нормы, закрепленные в религиозном мировоззрении, испытывают наибольшее давление со стороны постоянно нарастающего потока изменений во всех сферах жизни, обусловленного научно-техническим прогрессом, в том числе ВРТ.
В Русской Православной Церкви (РПЦ) разделяют понятия «искусственное оплодотворение» и «экстракорпоральное оплодотворение». Первое из них подразумевает искусственное введение в матку женщины половых клеток мужа, что не нарушает целостности брачного союза, второе – внетелесное оплодотворение, заготовление, консервацию и намеренное разрушение «избыточных» эмбрионов, что в целом недопустимо. Однако, по мнению священника А. Кнутова и протоиерея И. Аксенова, при данной трактовке отсутствует достаточная степень ясности и четкости, которая требуется для раскрытия вопросов в отношении человеческой жизни. Существует серьезная терминологическая ошибка: искусственное оплодотворение – это наименование явления, отличного от естественного зачатия, а ЭКО – конкретный метод искусственного оплодотворения. РПЦ соотносит искусственное оплодотворение и ЭКО как общее и частное, что создает значительные трудности при пастырском наставлении [65]. С точки зрения С.Л. Болховитиной, искусственное оплодотворение не должно являться противопоказанием и трудностью морального порядка для супружеской пары, поскольку речь идет об оказании врачебной вспомогательной помощи в акте деторождения [66]. Кроме этого, РПЦ не дает четкого ответа на вопрос, является ли нравственно допустимым формирование in vitro ограниченного числа эмбрионов с последующей пересадкой всех в полость матки, принимая во внимание, что многоплодная беременность нежелательна, расценивается как осложнение и сопряжена с повышенными перинатальными рисками для матери и ребенка. В ряде работ предполагается, что человек несет нравственную ответственность не только за «избыточные» эмбрионы, но и за пересаженные в матку эмбрионы, если беременность не возникнет и они погибнут. Пересадка эмбрионов в матку представляет собой эксперимент, ценой которого является человеческая жизнь [67]. Однако такая точка зрения не учитывает, что не менее 70% эмбрионов в условиях естественного зачатия не могут имплантироваться и погибают или происходит нарушение процессов эмбрионального развития. Кроме того, использование донорского материала нарушает целостность личности и исключительность брачных отношений, допуская наличие в них третьей стороны. На основании всего перечисленного использование ЭКО с христианской точки зрения является грехом [68].
Вторая по распространенности религия – ислам. Очевидно, что от отношения ислама к достижениям биомедицинских технологий, в частности к ВРТ, будет зависеть степень их внедрения в медицинскую практику и распространенности по всему миру. Наиболее полный и развернутый ответ исламского вероисповедания на вопросы, связанные с ВРТ, представлен в фикхе по вопросам биоэтики. Также существуют фетва об искусственном оплодотворении шейха Мухаммада Салих-аль-Мунаджида и целый ряд статей мусульманских авторов по вопросам биоэтики. Особенности исламского взгляда на ВРТ определяются прежде всего присущей ему точкой зрения об одушевлении плода в организме матери на 40-й день. В случаях, когда по причине того или иного заболевания естественное оплодотворение невозможно и было предпринято лечение, которое не помогло, ислам не препятствует проведению оплодотворения вне организма женщины. Однако к ЭКО не прибегают до тех пор, пока не был испробован и не удался естественный путь. При этом, согласно вердикту исламских богословов-законоведов, чтобы проведение такой процедуры было разрешено, «оплодотворение в пробирке» должно происходить сперматозоидом мужа яйцеклетки жены, а оплодотворенная яйцеклетка затем должна быть помещена в матку жены. Запрещается подсаживать яйцеклетку в матку другой женщины, т. е. суррогатной матери. Также запрещается проводить оплодотворение сперматозоидом мужа яйцеклетки другой женщины, не жены, даже если после этого яйцеклетка будет помещена в матку жены. Запрещается также оплодотворять яйцеклетку жены сперматозоидом другого мужчины, не мужа, даже если затем яйцеклетка будет помещена в матку жены. Три перечисленные формы оплодотворения запрещены по закону шариата, так как они ведут к смешению и потере родства, это запрещено в исламе [69].
Искусственное оплодотворение не противоречит буддийскому учению. Буддисты считают, что сознание не производится мозгом, оно существует всегда и само по себе. Когда яйцеклетка оплодотворяется сперматозоидом, в этот момент сознание соединяется, связывается с будущим телом, и уже тогда появляется живое человеческое существо. Поэтому нельзя бездумно относиться к гибели оплодотворенных эмбрионов, нужно всеми средствами стремиться, чтобы все они выживали. Учение о карме мотивирует буддистов действовать так, чтобы приносить счастье, радость, свободу и защиту существам, любить их и сочувствовать им и не совершать действий, приносящих страдание. Рождение и воспитание ребенка считаются одними из буддийских добродетелей. Если по состоянию здоровья нет возможности иметь детей естественным путем, можно усыновить ребенка, от которого отказались родители, и вернуть ему счастье в семье. Кроме этого, человек может воспользоваться всеми достижениями современной медицины для зачатия и вынашивания плода. Все пути возможны, и буддизм положительно относится к научным и технологическим открытиям, если они уменьшают физические и психические страдания существ и увеличивают количество их счастья. Социальные стереотипы не так важны, как индивидуальное счастье человека. Буддизм не налагает никаких жестких условий, ограничений и правил для проведения ЭКО [65].
Когда появились первые возможности искусственного оплодотворения, возник вопрос, разрешает ли это иудаизм. С точки зрения религиозных авторитетов в иудаизме, если супруги по объективным причинам медицинского или физиологического характера не могут зачать и родить детей обычным путем, они вправе прибегнуть к искусственному оплодотворению, в том числе с помощью ЭКО. Вопрос об использовании методов ЭКО для зачатия ребенка супружеской парой правоверных иудеев в каждом случае решается индивидуально, однако обычно религиозные авторитеты одобрительно относятся к такому решению, поскольку иудаизм разрешает использовать все существующие способы, чтобы продолжить свой род, нет ограничения ни на донорство спермы, ни на суррогатное материнство. Помимо этого, абсолютными доводами в пользу проведения программы ЭКО в иудаизме считаются необходимость помощи в выполнении заповеди «плодитесь и размножайтесь», обязанность совершать добрые поступки, облегчать страдания бесплодных пар, спасать целостность семьи [21]. Тем не менее в данной области существует ряд проблем: сомнения в установлении отцовства ребенка, родившегося в результате процедур ВРТ; сомнения в материнстве в случае программ ЭКО с донорскими яйцеклетками; сомнения в ответственности медицинского персонала, который может подменить или перепутать семя; оплодотворение донорской спермой может оказаться эквивалентным измене, если будущая мать замужем; если женщина не состоит в браке, такие процедуры приводят к проблеме разрушения понятия традиционной религиозной семьи. Проведение программ ЭКО с использованием биологического материала супружеской пары разрешается практически всеми религиозными авторитетами в иудаизме [70]. При этом часть вопросов между ВРТ и религией остаются дискутабельными.
При анализе этих норм становится очевидным, что их реализация способствует сохранению и укреплению как духовного, так и физического благосостояния человека, что является одной из высших ценностей в Конституции Российской Федерации, статья 28 которой гласит: «Каждому гарантируется свобода совести, свобода вероисповедания, включая право исповедовать индивидуально или совместно с другими любую религию или не исповедовать никакой, свободно выбирать, иметь и распространять религиозные и иные убеждения и действовать в соответствии с ними». Эта норма позволяет исповедовать религию с соблюдением всех канонов (не противоречащих законам Российской Федерации).
С 12.04.2020 вступили в силу изменения в Федеральный закон от 21.11.2011 №323-ФЗ (ред. от 01.04.2020) «Об основах охраны здоровья граждан в Российской Федерации» (с изм. и доп., вступ. в силу с 12.04.2020), где в пункте 1 статьи 27 говорится, что граждане обязаны заботиться о сохранении своего здоровья [18]. «Здоровье человека является высшим неотчуждаемым благом, без которого утрачивают свое значение многие другие блага и ценности, а следовательно, его сохранение и укрепление играют основополагающую роль как в жизни каждого человека, так и в жизни общества и государства…» [24]. При этом возможность репродуктивной реализации зачастую лежит в основе духовного, социального и психологического комфорта.
Заключение
Мужское бесплодие – сложный и гетерогенный процесс, точная этиология которого в половине случаев не поддается объяснению. Тем не менее существуют прямые корреляционные связи бесплодия с повышенным риском развития злокачественных новообразований у мужчин. Однако многие современные эпидемиологические исследования мужского бесплодия и его потенциальные риски осложнены низким уровнем отчетности проведенных исследований. Мужской фактор бесплодия должен стать важным показателем качества здоровья, выходящего за рамки способности зачать ребенка. При этом понимание правовых и религиозных аспектов поможет создать благоприятные юридические, социально-биологические и общечеловеческие принципы для реализации репродуктивной функции при всем многообразии возможностей.
Поэтому, несмотря на дальнейшее развитие новых методов сохранения фертильности в будущем, в настоящее время необходимо добиться максимальной интеграции репродуктивных технологий в рутинную практику онкологов в целях повышения качества жизни онкологических пациентов.

Закон СССР от 19.12.1969 №4589-7 «Об утверждении основ законодательства Союза ССР и союзных республик о здравоохранении» (Ведомости Верховного Совета СССР, 1969, №52, ст. 466).
Шейх Абд аль-Маджид аз-Зиндани, Шейх Мустафа Ахмад, Кейт Мур. Стадии развития человеческого эмбриона (по Корану и Сунне).



















