
Злокачественные опухоли на протяжении многих лет остаются одной из ведущих причин смерти во всем мире, их распространенность увеличивается. Стандартные методы их терапии обладают рядом недостатков, среди которых отсутствие клеточной избирательности действия и серьезные побочные эффекты препаратов. Работа над новыми высокотехнологичными лекарственными средствами ведется постоянно, она связана с изучением тонких патофизиологических механизмов онкогенеза и его регуляции. Отдельное значение ученые придают так называемым «спящим», или дормантным (лат. dormantis – спящий), опухолевым клеткам.
У многих онкологических пациентов метастатические поражения появляются спустя значительное время после лечения первичной опухоли, которое считали успешным. Ученые обнаруживали диссеминированные опухолевые клетки (ДОК) в костном мозге и других органах у пациентов без признаков метастатической болезни. Иначе говоря, покинувшая первичный очаг популяция раковых клеток способна выжить после системной терапии и стать источником будущих метастазов. Способность персистирующих ДОК входить в дормантное состояние – одна из причин непредсказуемости сроков метастазирования, она становится серьезным препятствием для стойкого длительного излечения. Что «пробуждает» эти клетки от «спячки», остается неизвестным.
Дормантные клеточные элементы в подавляющем большинстве случаев не могут быть обнаружены на современном уровне развития диагностических методик. Однако состояние покоя опухолевых клеток может дать уникальное терапевтическое «окно» для предотвращения метастазирования. Потенциально это может открыть новые возможности в борьбе с рецидивами. Воздействие на механизмы, которые обычно способствуют рецидивированию рака, возможно, предотвратит активацию («пробуждение») популяций дормантных диссеминированных опухолевых клеток (дДОК) в их резервуарах.
Дормантные ДОК имеют множество генетических аномалий, но при этом часто не способны возобновить рост в течение многих лет. Это свидетельствует в пользу того, что важнейшим фактором в определении времени прогрессирования опухоли может оказаться характер микроокружения в участках метастазирования.
Исследование: естественные киллеры, звездчатые клетки печени и метастазы
Работа группы швейцарских ученых, опубликованная в Nature, обнаружила ряд факторов микроокружения, которые могут оказывать влияние на вероятность развития метастазов из дДОК в печени после лечения рака молочной железы (РМЖ). В экспериментах на мышах натуральные киллеры (NK-клетки) обеспечивали состояние покоя дДОК опосредованно, через интерферон гамма (INF-γ), предотвращая развитие метастазов в печени и продлевая безрецидивный период. Поддержанию их пула способствовала адъювантная иммунотерапия на основе интерлейкина-15 (IL-15). Пролиферацию NK-клеток подавляли активированные звездчатые клетки печени при помощи хемокина CXCL12 (известного также как SDF-1). Существенное сокращение количества натуральных киллеров сопровождалось выходом дДОК из «спячки». Эти процессы наглядно демонстрирует рисунок.
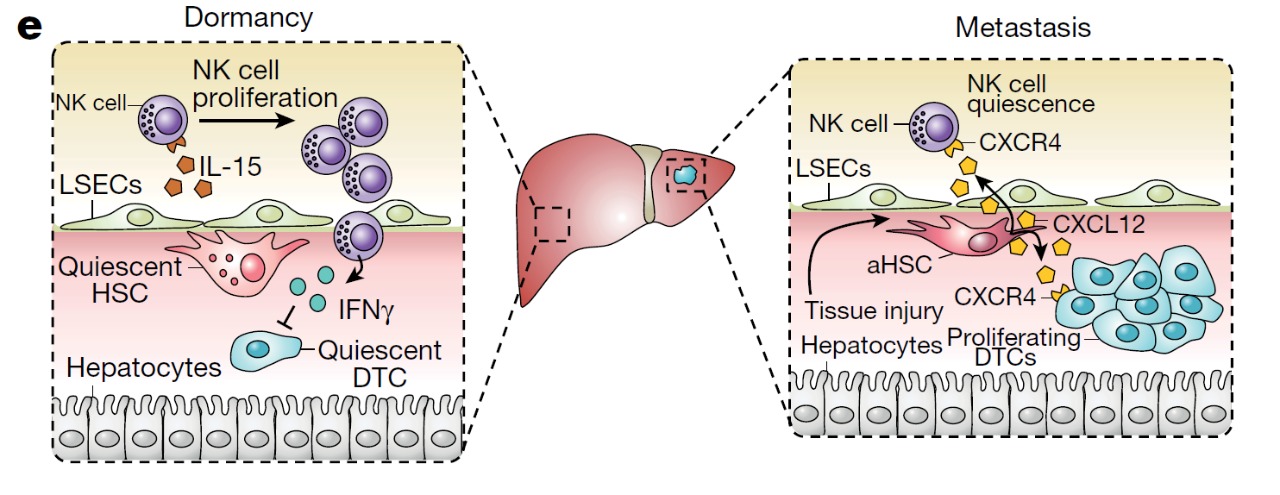
Модель, которая суммирует взаимодействие NK-клеток и звездчатых клеток печени в качестве главного контроллера дормантности опухолевых клеток. Объяснение в тексте. Источник
Ранее уже было известно, что NK-клетки, звездчатые клетки печени, CXCL12, IL-15 и IFN-γ играют роль в процессе развития метастазов. Однако эта работа – первая, в которой рассматривают пути взаимодействия всех этих биологических агентов.
В чем новизна исследования?
NK-клетки могут действовать на ДОК опосредованно
Определенные аспекты влияния NK-клеток на процесс формирования метастазов сравнительно хорошо изучены. Согласно сегодняшнему представлению опухолевые клетки уклоняются от надзора естественных киллеров, изменяя репертуар мембранных рецепторов и спектр сигналов, которые используют NK-клетки для различения злокачественных и здоровых клеточных элементов. Эта тактика лежит в основе состояния покоя опухоли. ДОК могут входить в аутоиндуцированную дормантность, снижать уровень активаторов NK-клеток и избегать опосредованной этими клетками цитотоксичности.
Швейцарские ученые продемонстрировали альтернативный цитостатический IFN-γ-опосредованный механизм NK-клеточного иммунитета, который необходим для поддержания дормантного состояния метастатического РМЖ. Новые данные не исключают возможности цитотоксического воздействия NK-клеток in vivo. В то же время они поддерживают точку зрения, согласно которой размер NK-клеточного пула и присутствие IFN-γ в микросреде печени оказывают определяющее влияние на состояние дормантности и процесс метастатического роста.
Роль IFN-γ в поддержании дормантного состояния ДОК
Полученные швейцарскими учеными результаты помогают понять механизмы фазы равновесия процесса иммуноредактирования рака, в которой IFN-γ, IL-12, IL-23 и Т-клеточно-опосредованная цитотоксичность обеспечивают баланс процессов гибели и пролиферации раковых клеток. Новые данные подчеркивают, что цитостатические эффекты NK-клеток по отношению к ДОК РМЖ обусловлены не только классическими киллинговыми функциями адаптивного иммунитета. Становится ясным, что IFN-γ может действовать как регулятор состояния равновесия, приводя опухолевую массу к дормантному состоянию посредством Т-клеточно-опосредованной цитотоксичности или прямого индуцирования покоя ДОК. Ранее ученые предполагали, что такой механизм задействован в поддержании дормантности ДОК при множественной миеломе.
IFN-γ считают прогностическим фактором успешного лечения рака. Однако его использованию в клинической практике мешало в том числе его слабое влияние на исход болезни на поздних стадиях рака. Описанное исследование показало влияние IFN-γ на более ранние фазы онкогенеза и продемонстрировала возможные перспективы его терапевтического использования – для создания непермиссивной цитокиновой среды, необходимой для ограничения выхода ДОК из состояния покоя.
Фиброзное повреждение может запускать переход от дормантности к метастазам
Ранее было известно, что фиброзное повреждение существенно нарушает тканевый гомеостаз и само по себе может вызывать реактивацию дДОК в легких. Новые данные говорят о том, что активированные звездчатые клетки печени контролируют этот процесс в печени секрецией CXCL12, который угнетает и вводит в состояние покоя NK-клетки, таким образом подавляя иммунный надзор и обеспечивая реактивацию ДОК.
Иммуноингибирующий эффект CXCL12, описанный в швейцарском исследовании, напоминает действие раково-ассоциированных фибробластов при раке поджелудочной железы. В последнем случае CXCL12 приводит к исключению Т-клеток из опухолевых зон. Вероятно, CXCL12 вызывает NK-клеточную супрессию и тоже исключает как NK-, так и T-клетки из микроокружения ДОК, обеспечивая низкое содержание лимфоцитов, что благоприятствует метастазированию.
Таким образом, дормантность ДОК достигается путем поддержания тканевого гомеостаза (в частности, иммунной и соединительнотканной составляющих), нарушения же физиологии тканей создают условия для их реактивации. В жизни этот механизм проявляется в повышенном риске развития метастазов на фоне снижения защитных возможностей организма во время старения, после рецидивирующих инфекций и под влиянием связанных с образом жизни негативные триггеров (например, алкоголя, ожирения и курения).
Как новые данные в будущем могут повлиять на клиническую практику
В дальнейшем необходимо будет установить, можно ли проецировать описанные швейцарскими учеными механизмы регуляции метастатического процесса на организм человека. Еще один вопрос – окажутся ли выявленные закономерности справедливыми для метастатических зон в других органах. Кроме того, со временем встанет проблема разработки методов обнаружения «спящих» клеток у пациентов, успешно прошедших начальное противоопухолевое лечение.
Результаты исследования могут способствовать появлению новых диагностических методик. Поскольку размер NK-клеточного пула, судя по всему, может сам по себе влиять на метастатическую экспансию, обнаружение снижения количества этих клеток у людей со злокачественными образованиями в анамнезе может помочь в выявлении лиц с риском рецидива.
Основываясь на полученных результатах, ученые предполагают, что подходы к лечению злокачественных опухолей могут включать:
- адъювантную NK-клеточную иммунотерапию;
- иммунотерапию на основе IL-15 для увеличения количества NK-клеток;
- терапию IFN-γ для поддержания дормантного состояния опухолевых клеточных элементов;
- терапию ингибиторами рецептора CXCR4.
Такие методики существуют в том или ином виде, но нуждаются в дальнейшем исследовании. Реализация этих терапевтических стратегий может стать серьезным шагом в персонифицированном лечении рака.

Опуская некоторые детали, разберемся в ходе исследования.
ДОК и микроокружение
Ученые использовали экспериментальную модель спонтанного метастазирования РМЖ. Они получили клетки РМЖ с необходимыми параметрами при помощи генной инженерии и имплантировали их в молочные железы иммунокомпрометированных мышей. Через некоторое время мышам удалили первичные опухоли. Исследователи обнаружили ДОК в образцах из разных тканей подопытных животных, наибольшее их количество было сосредоточено в печени. Анализ выявил в этом органе сосуществование различных стадий заболевания. Часть ДОК – преимущественно в метастазах – была в активной, делящейся, форме. Однако чаще – в большей части органа, которая выглядела здоровой, – можно было найти дДОК в виде рассеянных одиночных клеток или небольших скоплений (до 10 клеток).
Далее исследователи провели глобальное транскриптомное профилирование печени в отделах, содержавших дДОК, и в области метастазов. Последние были богаты транскриптами, связанными с делением клеток. В то же время в районе покоящихся клеток наблюдались сигналы, которые ранее связывали со «спячкой». То есть состояние микроокружения было связано с судьбой ДОК.
ДОК и естественные киллеры
Естественные киллеры были единственными иммунными клетками, количество которых увеличилось в дормантных средах по сравнению с невовлеченными в опухолевый процесс участками печеночной ткани. Их популяция росла за счет резидентных NK-клеток печени. Зоны метастазов были заселены миелоидными субпопуляциями, которые в предыдущих исследованиях были связаны с развитием метастазов РМЖ.
Далее ученые провели иммунокомпетентным мышам экспериментальную терапию, которая истощала пул NK-клеток. Оказалось, что такое истощение приводит к активации ДОК и реактивации дДОК во многих органах и особенно ускоряет развитие метастазов в печени.
После лечения животных IL-15 количество NK-клеток в печени увеличилось, а метастазов – уменьшилось. Эксперименты in vitro подтвердили, что интерлейкин поддерживает дормантность ДОК опосредованно, через экспансию NK-клеток. Увеличение количества последних было связано с увеличением выживаемости подопытных животных.
Как естественные киллеры поддерживают покой дДОК
Ученые обнаружили, что как покоящиеся, так и обычные ДОК примерно одинаково чувствительны к цитотоксичности NK-клеток. Далее они выяснили, что в NK-клетках тканей со спящими раковыми клетками наблюдалась активация многих путей синтеза цитокинов, включая фактор некроза опухоли (TNF) и интерферон-γ (IFN-γ). Иммунопрофилирование различных сред печени и эксперименты с клеточными культурами подтвердили, что, по всей видимости, NK-клетки контролируют дДОК через IFN-γ-индуцированное состояние покоя.
Звездчатые клетки печени и естественные киллеры
Когда ученые стремились выявить, какие механизмы подавляют экспансию NK-клеток, они обнаружили, что в прогрессировании метастазов играют роль активированные звездчатые клетки печени (аЗКП). Ранее было известно, что эти клетки важны для развития фиброза, часто предшествующего появлению рака. Эксперименты показали, что активирование ЗКП со временем приводит к снижению количества естественных киллеров в печени мышей.
Учитывая важность ЗКП-опосредованной паракринной сигнализации в норме и патологии, исследователи предположили, что ингибирующее пролиферацию NK-клеток действие аЗКП обусловлено секретируемыми ими факторами. Эксперименты на культурах клеток, включая протеомный анализ кондиционированных сред аЗКП и гепатоцитов, привели ученых к выводу, что пролиферацию NK-клеток подавляет хемокин CXCL12, который вырабатывают аЗКП.
Было обнаружено, что метастатические среды печени мышей с большим содержанием aЗКП и CXCL12 содержат гораздо больше покоящихся NK-клеток, чем дормантные и свободные от опухоли зоны. Почти все NK-клетки, содержащие хемокиновый рецептор CXCR4, находились в состоянии покоя. Далее ученые установили, что CXCL12 способен усиливать пролиферацию ДОК и напрямую. Наличие рецепторов CXCR4 у ДОК хоть и ускоряло рост метастазов, но оказалось необязательным фактором для их развития.
Исследование человеческих тканей
В заключение ученые взяли у пациенток с РМЖ парные биопсии: метастазов и нормальной окружающей ткани печени. Анализ препаратов дал результаты, сходные с теми, которые были получены в экспериментах на мышах. Активные ЗКП аккумулировались в метастазах, их содержание обратно коррелировало с количеством NK-клеток.
Содержание aЗКП обратно коррелировало с количеством NK-клеток и в биопсиях людей с хроническими заболеваниями печени без метастатического поражения. По мнению ученых, это подтверждает тезис, что вызванное активацией ЗКП нарушение гомеостаза NK-клеток является общей характеристикой в развитии хронических болезней печени и опухолевого метастазирования.
Некоторые данные указывают на то, что свежие находки ученых, вероятно, можно проецировать на другие опухоли. Ранее транскриптомный анализ демонстрировал подобную обратную корреляцию между сигнатурами экспрессии генов NK-клеток и aЗКП в печени при метастазировании колоректального рака. Кроме того, при изучении сравнительно крупной когорты пациентов было обнаружено, что экспрессия CXCL12 коррелирует с повышением концентрации aЗКП в печеночных метастазах при различных типах рака.




















Очень интересно.